Comment les cellules T tueuses savent-elles d'où vient le danger ?
Signaux routiers pour les cellules de défense immunitaire - Une étude permet de mieux comprendre le fonctionnement interne de la réponse immunitaire adaptative.
Comment les cellules T tueuses reconnaissent-elles les cellules de l'organisme qui ont été infectées par des virus ? La matière étrangère à l'organisme est présentée à la surface de ces cellules sous forme d'antigènes qui agissent comme une sorte de panneau routier. Un réseau de protéines accessoires - les chaperons - veille à ce que ce panneau conserve sa stabilité dans le temps. Des chercheurs de l'université Goethe sont maintenant parvenus à une compréhension complète de ce processus essentiel de contrôle de la qualité cellulaire. Leur exposé sur les bases structurelles et mécanistiques des réseaux de chaperons vient de paraître dans la revue scientifique Nature Communications. Ces nouvelles découvertes pourraient être le signe avant-coureur de progrès dans des domaines tels que le développement de vaccins.
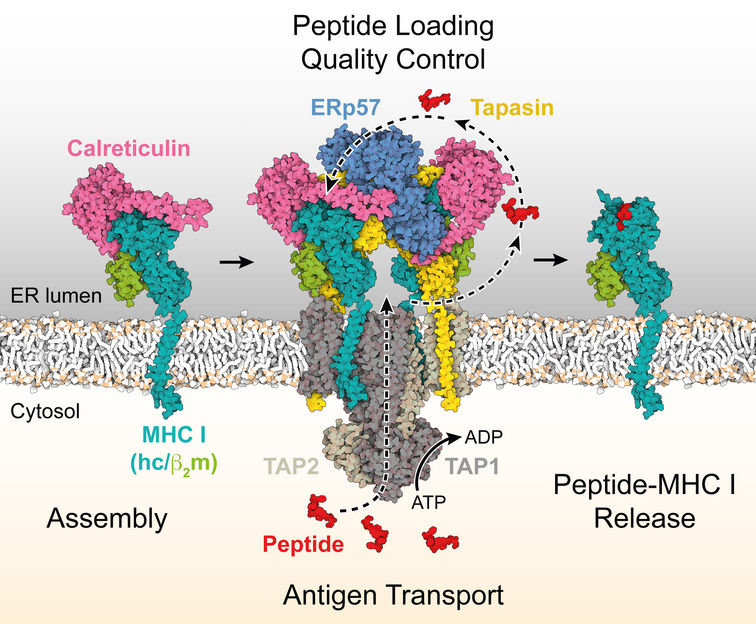
Le complexe de chargement peptidique entièrement assemblé, mécanisme de traitement des antigènes, est formé par le complexe de transport d'antigènes TAP1/2, les chaperons calréticuline, ERp57 et tapasine, et le CMH I hétérodimérique (chaîne lourde et légère en sarcelle et vert).
Christoph Thomas & Robert Tampé, Goethe-Universität Frankfurt
Les organismes sont constamment envahis par des agents pathogènes tels que les virus. Notre système immunitaire se met en action pour combattre immédiatement ces agents pathogènes. La réponse immunitaire innée non spécifique est déclenchée en premier lieu, suivie de la réponse immunitaire adaptative ou acquise. Dans cette deuxième réaction de défense, des lymphocytes T cytotoxiques spécialisés, appelés cellules T tueuses, détruisent les cellules de l'organisme qui ont été infectées et empêchent ainsi la propagation des dommages. L'être humain possède un répertoire de quelque 20 millions de clones de cellules T dont la spécificité varie pour contrer la multitude d'agents infectieux existants. Mais comment les cellules T tueuses savent-elles d'où vient le danger ? Comment reconnaissent-ils que quelque chose ne va pas à l'intérieur d'une cellule où se cachent des virus ? Ils ne peuvent pas simplement jeter un coup d'œil rapide à l'intérieur.
C'est à ce stade que le traitement de l'antigène entre en jeu. Ce processus peut être comparé à la fabrication d'un panneau de signalisation. Le code-barres moléculaire est "traité" ou assemblé dans la cellule - dans le réticulum endoplasmique, pour être exact. Des molécules spéciales sont utilisées pour sa fabrication, les molécules du CMH de classe 1. Elles sont chargées d'informations sur l'envahisseur viral dans une machine moléculaire, le complexe de chargement de peptides (PLC). Ces informations sont constituées de peptides, fragments de la protéine étrangère à l'organisme. Ces fragments contiennent également des épitopes, les segments moléculaires qui déclenchent une réponse immunitaire spécifique. Au cours du processus de chargement, un complexe CMH I-épitope peptidique se forme donc, et c'est le panneau de signalisation qui est ensuite transporté à la surface de la cellule et présenté sous une forme facilement accessible aux cellules T tueuses - on pourrait presque dire qu'il leur est remis sur un plateau d'argent. Les chaperons, des protéines accessoires spéciales qui aident au pliage correct des protéines à structure complexe dans les cellules, jouent également un rôle important.
Les chaperons qui contribuent au traitement des antigènes sont la calréticuline, ERp57 et la tapasine. Mais comment fonctionnent-elles ensemble ? Et quelle est leur importance pour le traitement des antigènes ? Une étude menée par l'université Goethe de Francfort et l'université d'Oxford, publiée dans Nature Communications, vient d'apporter une réponse. "Avec cette étude, nous avons réalisé une percée dans notre compréhension du contrôle de la qualité cellulaire", déclare le professeur Robert Tampé, directeur de l'Institut de biochimie de l'université Goethe de Francfort. Il explique la logique qui sous-tend ce processus de contrôle de la qualité comme suit : "Le complexe CMH I-épitope peptidique, le panneau de signalisation, doit être exceptionnellement stable, et pendant assez longtemps, car la réponse immunitaire adaptative ne se déclenche pas instantanément. Elle a besoin de 3 à 5 jours pour se mettre en route." Le panneau ne doit donc pas s'effondrer au bout d'un jour ; ce serait désastreux, car les cellules de défense immunitaire ne détecteraient alors pas les cellules infectées par un virus. Elles ne détruiraient donc pas ces cellules et le virus pourrait poursuivre sa propagation sans entrave. Un problème similaire se poserait si une cellule de l'organisme avait muté en une cellule tumorale : la menace ne serait pas détectée. Il est donc impératif de mettre en place un système de contrôle de la qualité.
Comme le montre l'étude, les chaperons sont des éléments centraux du processus : ils confèrent à la signalisation routière la stabilité à long terme qu'elle doit avoir en opérant une sélection rigoureuse. En rejetant les fragments de virus à courte durée de vie dans la masse de matériel disponible, ils garantissent que seules les molécules du CMH I chargées des meilleurs et des plus stables épitopes peptidiques en complexe avec le CMH I sont libérées du complexe de chargement des peptides. Les chaperons ont des tâches différentes dans ce processus de sélection si important pour la réponse immunitaire adaptative, explique Tampé : "La tapasine agit comme un catalyseur qui accélère l'échange des épitopes peptidiques sous-optimaux contre des épitopes optimaux. La calréticuline et ERp57, en revanche, se déploient de manière universelle." Cette approche concertée garantit que seuls les complexes stables du CMH I avec des épitopes peptidiques optimaux atteignent la surface cellulaire et remplissent leur rôle de guidage des cellules T tueuses vers la cellule infectée ou mutée.
Dans quelles directions l'étude s'oriente-t-elle ? "Nous comprenons maintenant mieux quels peptides sont chargés et comment cela se produit. Nous pouvons également prédire de manière plus fiable les épitopes peptidiques dominants, autrement dit les épitopes peptidiques stables qui seront sélectionnés par le réseau de chaperons." Mme Tampé espère que ces nouvelles découvertes s'avéreront utiles pour la mise au point de futurs vaccins contre des variantes de virus. Elles pourraient également faciliter les progrès des futures thérapies contre les tumeurs. "Les deux sujets sont directement liés. Mais les applications en matière de thérapie des tumeurs sont certainement plus complexes et s'inscrivent davantage dans le long terme."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.