Impact de météorite dans le cerveau
Traitement de l'AVC aigu en médecine personnalisée
Un caillot de sang dans le cerveau qui bloque l'apport d'oxygène peut provoquer une attaque aiguë. Dans ce cas, chaque minute compte. Une équipe de l'Empa, de l'Hôpital universitaire de Genève et de la Clinique Hirslanden est en train de développer une procédure de diagnostic permettant de commencer à temps une thérapie adaptée, comme ils l'écrivent dans le numéro actuel de la revue scientifique Scientific Reports.
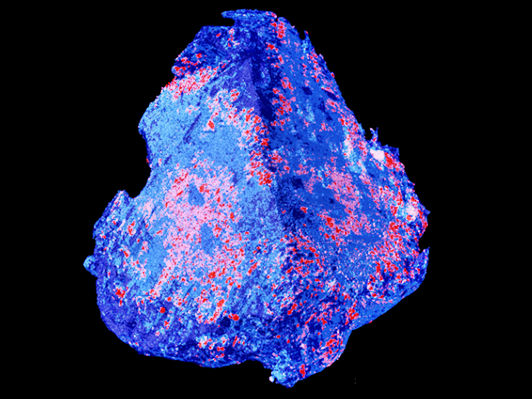
Beauté cruelle : caillot sanguin d'environ 1,5 millimètre de large sur une image de tomographie microcompactée tridimensionnelle (en couleur).
Empa
Il n'y a aucun signe avant-coureur : D'un moment à l'autre, des zones entières du cerveau sont bloquées. Lorsqu'un caillot obstrue un vaisseau sanguin, l'apport d'oxygène au cerveau est interrompu et la personne concernée subit une attaque cérébrale aiguë. Cette affection, qui met la vie en danger, peut se manifester de différentes manières : paralysie musculaire, perte de l'ouïe ou de la vue, perte de conscience, etc. Mais une chose est sûre : Il s'agit d'une urgence médicale et le délai de résolution de l'obstruction vasculaire doit être le plus court possible afin d'éviter la mort d'un maximum de cellules nerveuses. C'est le seul moyen d'éviter des dommages neurologiques permanents.
Il n'est pas toujours facile de déterminer dans l'urgence quel est le traitement le mieux adapté à cette fin. Sur la base de l'analyse aux rayons X et de la microscopie électronique, une équipe de l'Empa, de la Clinique Hirslanden et de l'Hôpital universitaire de Genève développe actuellement une méthode qui devrait permettre d'identifier la thérapie optimale dans les plus brefs délais. Une première étude a été publiée dans la revue scientifique Scientific Reports. Ces données devraient servir de base à un traitement sur mesure dans le sens d'une médecine personnalisée.
Dépister chaque cellule individuellement
La raison de ce dilemme : tous les caillots sanguins ne sont pas identiques ; selon le type, différents types de cellules peuvent s'agglutiner. Selon que les globules rouges ou les globules blancs prédominent, ou selon la proportion de fibres de fibrine, le thrombus a des propriétés complètement différentes. En outre, les thrombus ont des formes très différentes. Un thrombus de 15 millimètres de long qui ne remplit pas complètement un vaisseau sanguin a des propriétés mécaniques différentes de celles d'un caillot de quelques millimètres qui bloque complètement un vaisseau et l'approvisionnement en sang des zones cérébrales situées derrière. Le traitement optimal dépend de ces différences, qu'il s'agisse de dissoudre le caillot avec des médicaments ou d'utiliser un "stent retriever", une sorte de minuscule canne à pêche avec laquelle le thrombus dans le vaisseau sanguin peut être "repêché" et dont le matériau peut être choisi différemment selon le thrombus.
La radiologie s'appuie actuellement sur la tomographie conventionnelle pour prendre la décision thérapeutique. Cependant, les images de la tête du patient fournissent peu d'informations sur les détails d'un caillot car les objets constitués de matériaux similaires sont trop difficiles à distinguer les uns des autres et à résoudre dans l'espace. De plus, dans la pratique clinique quotidienne, la résolution des images est limitée à 200 micromètres.
Il en va autrement avec les méthodes de laboratoire, que les chercheurs ont utilisées pour leur nouvelle étude : L'équipe, avec la participation de Robert Zboray, Antonia Neels et Somayeh Saghamanesh du Center for X-Ray Analytics de l'Empa, avait examiné différents caillots sanguins prélevés sur des patients lors d'interventions neurochirurgicales. Pour ce faire, différentes technologies de laboratoire ont été combinées, ce qui a permis d'obtenir des images virtuelles en 3D qui ont révélé des propriétés détaillées et jusqu'alors inconnues des caillots sanguins. "Nous avons utilisé la micro-tomographie 3D pour examiner les globules rouges individuels jusqu'à l'échelle du micromètre", explique Zboray, chercheur à l'Empa. Une telle tomographie utilisant des techniques de contraste de phase produit un contraste plus fort. Les objets faciles à pénétrer, comme les muscles, le tissu conjonctif ou les caillots sanguins, peuvent ainsi être visualisés dans des nuances particulièrement fines et dans leur répartition spatiale.
Thrombi calcifiés
D'autres technologies telles que la microscopie électronique à balayage et les méthodes de diffraction et de diffusion des rayons X ont fourni des informations supplémentaires jusqu'au niveau atomique. Il a ainsi été démontré pour la première fois qu'un thrombus n'est pas seulement constitué de cellules sanguines et de réseaux de fibrine, mais qu'il peut même être parsemé de minéraux tels que l'hydroxyapatite, comme on le sait des parois des vaisseaux lors de la calcification artérielle.
Cependant, ces informations détaillées sur les particularités d'un caillot sanguin arrivent trop tard, lorsque le thrombus a déjà été retiré chirurgicalement. En outre, les données nouvellement acquises ne peuvent pas être comparées aux images et résultats conventionnels de l'hôpital. La numérisation de la médecine, quant à elle, permet de modéliser les données de manière à ce qu'un algorithme puisse lire les informations détaillées à l'avenir. "Pour ce faire, nous devons encore étudier un grand nombre de thrombus afin de pouvoir utiliser l'apprentissage automatique pour identifier de nouvelles caractéristiques et de nouveaux modèles d'images concernant la composition du caillot, qui peuvent ensuite être transférés aux images conventionnelles de l'hôpital pour aider à distinguer les différents types de thrombus", a déclaré Zboray.
À terme, les chercheurs espèrent que, grâce à leurs découvertes, les images hospitalières classiques pourront être interprétées en un temps très court, comme si le caillot sanguin avait été examiné dans un laboratoire virtuel ultrarapide. Cela ouvrirait la voie à une thérapie plus précise et personnalisée pour les patients victimes d'un accident vasculaire cérébral en temps voulu.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.