Hépatite : découverte de la structure 3D de la porte d’entrée du foie
C’est une porte d’entrée essentielle du foie, pourtant encore peu décrite jusqu’à aujourd’hui. NTCP (pour Na+-taurocholate co-transporting polypeptide) est une protéine située dans la membrane des cellules hépatiques, et exclusive dans ces cellules, qui leur permet de recycler les acides biliaires. Elle est également la cible des virus humains de l'hépatite B et D (VHB/VHD). Mieux la comprendre pourrait donc mener d’une part au développement de traitements ciblant spécifiquement le foie, et d’autre part à lutter contre l’infection par le VHB et le VHD.
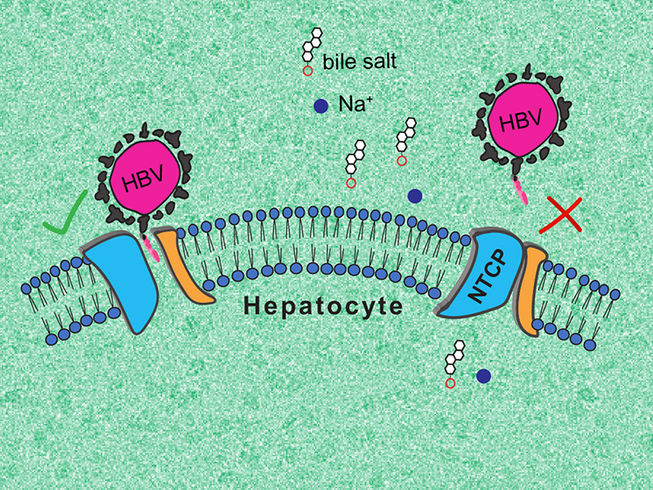
Illustration des deux conformations 3D adoptées par les NTCP. À gauche : conformation "ouverte" à laquelle le VHB et le VHD peuvent se lier. À droite : conformation "fermée" qui empêche la reconnaissance par les virus.
© Kapil Goutam/Nicolas Reyes/CNRS
NTCP est une protéine difficile à étudier. Elle ne pèse que 38 kilodalton (kDa) alors que la technologie utilisée pour étudier ce type de molécules, la cryo-microscopie électronique, ne fonctionne que pour des molécules dont le poids est supérieur à 50 kDA. Tout l’enjeu était donc de la « grossir » et de la stabiliser.
Pour cela, les équipes de laboratoires français et belge ont mis au point et testé toute une collection de fragments d’anticorps ciblant NTCP. La structure 3D des complexes ainsi formés a pu être déterminée par cryo-microscopie électronique pour ensuite remonter à celle de la protéine. Les différents fragments d'anticorps ont de plus permis de stabiliser plusieurs formes de NTCP et ainsi de les observer.
L’équipe de recherche a pu décrire deux conformations que peut adopter NTCP : une première où la protéine ouvre une large porte d’entrée pour les sels biliaires, à laquelle le VHB et le VHD peuvent se fixer, et une deuxième, « fermée », repliée de telle manière qu’elle empêche le ciblage par les virus.
La première conformation, « ouverte », est très surprenante, car aucun autre transporteur moléculaire connu ne forme de pore de ce genre, « grand ouvert ». Quant à la deuxième, elle pourrait aider à guider la recherche de molécules empêchant l’infection par le VHB et le VHD. L’équipe de recherche compte désormais poursuivre ses travaux pour élucider pleinement le fonctionnement de NTCP.