Investigación bajo presión
Por qué se necesitan 3.000 barritas para analizar a fondo una proteína
Los investigadores de Constanza Frederic Berner y Michael Kovermann presentan un nuevo método de espectroscopia de alta presión para desentrañar las propiedades de las estructuras nativas de las proteínas.
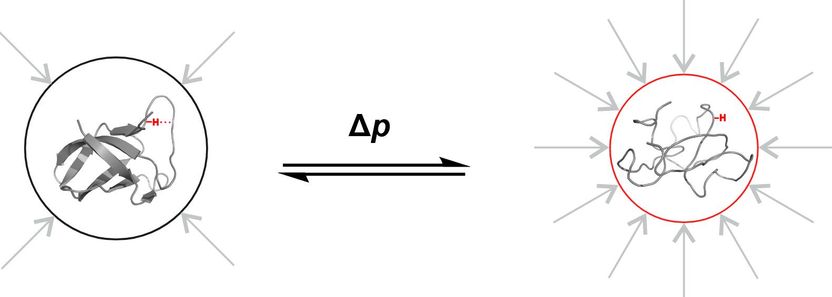
Imagen esquemática del plegamiento de la proteína de choque frío B de Bacillus subtilis en función de la presión hidrostática. La cadena de aminoácidos se pliega como una cinta de papel.
Copyright: AG Kovermann, Universität Konstanz
Se aplica una presión de 3.000 bares a la proteína de choque frío B del Bacillus subtilis en un pequeño tubo del laboratorio de espectroscopia de RMN de la Universidad de Constanza. Esto es aproximadamente tres veces la presión del agua en el punto más profundo del océano. La presión es tan intensa que la proteína, muy dinámica, muestra características estructurales que no serían suficientemente visibles a presión normal. Pero, ¿por qué aplican los científicos una presión tan alta, que no se da en ningún otro lugar de nuestro planeta en condiciones naturales? La respuesta es: Para estudiar procesos y propiedades demasiado volátiles para ser observados en condiciones normales.
"Esta alta presión nos permite hacer visibles estados que realmente existen a 1 bar, pero que sólo podemos observar directamente a 3.000 bar", explica Frederic Berner, de la Universidad de Constanza. Literalmente "a alta presión", el investigador doctoral investiga las propiedades de una proteína determinadas por su estructura, y cómo los cambios en la estructura influyen a su vez en sus propiedades. En el grupo de investigación Química Física y Resonancia Magnética Nuclear de la Universidad de Constanza, dirigido por Michael Kovermann, ha puesto en práctica recientemente un nuevo método para analizar las propiedades estructurales de las proteínas a 3.000 bares con la menor influencia posible de los efectos circundantes. Los dos investigadores presentan ahora su nuevo enfoque metodológico en la revista Angewandte Chemie International Edition.
Proteínas: cómo influye la estructura en sus propiedades
Las proteínas son los componentes básicos de la vida. Están formadas por cadenas de aminoácidos cuya estructura tridimensional puede adoptar formas muy diversas. Se "pliegan" del mismo modo que una larga cinta de papel puede doblarse en diferentes formas. Las propiedades funcionales de una proteína dependen en gran medida de su plegamiento, de modo que una misma proteína puede tener efectos muy diferentes en la célula, según la forma en que esté plegada. "Lo importante de las proteínas es su estructura, que a su vez está ligada a las funcionalidades. Si quieres identificar mecanismos bioquímicos, necesitas información sobre su estructura", afirma Berner.
El objetivo de los científicos es captar las propiedades de la estructura de la proteína en su forma "pura", es decir, lo más libre posible de las influencias de su entorno. Por dos razones, sin embargo, esto no es tan fácil: en primer lugar, casi siempre hay interacciones con el disolvente que rodea a la proteína y con las secciones vecinas de su cadena molecular. En segundo lugar, las proteínas son muy dinámicas, su plegamiento está siempre en movimiento. Por ejemplo, hay proteínas que se pliegan y se vuelven a plegar constantemente como unas tijeras. En la fracción de segundo que se abre, se produce una reacción química. Esto ocurre demasiado rápido para que los investigadores puedan examinarlo directamente.
Bajo alta presión
Y aquí es donde entra en juego la presión de 3.000 bares: Se presiona a la molécula para que adopte un determinado estado: se manipula su estructura: Las tijeras permanecen abiertas. Gracias a la espectroscopia de resonancia magnética, los investigadores pueden ahora estudiar propiedades estructurales específicas de la proteína que no son directamente visibles a presión normal.
Los métodos de análisis anteriores suelen aceptar los efectos ambientales e intentan factorizarlos a posteriori. El nuevo método de alta presión de Kovermann y Berner, por el contrario, puede suprimir o "corregir" los efectos ambientales desde el principio ("intrínsecamente") y permite así una visión de la proteína lo menos afectada posible. Tiene especial sentido utilizar y comparar el nuevo método en combinación con los métodos existentes, ya que así se hacen visibles en detalle los diversos factores que influyen. El proceso de alta presión inventado en la Universidad de Constanza ha dado muy buenos resultados incluso en la fase inicial de su aplicación. Frederic Berner y Michael Kovermann explican que ahora se llevarán a cabo más experimentos y simulaciones por ordenador para seguir probando y, potencialmente, perfeccionar el proceso.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.