Fábrica de ácidos grasos filmada en funcionamiento
Las imágenes de alta resolución aportan nuevos conocimientos sobre la producción celular de ácidos grasos: potencial para la medicina y la biotecnología
Los ácidos grasos son esenciales en todos los organismos vivos: para almacenar energía, formar membranas y multiplicarse. Los produce una compleja maquinaria celular: la sintasa de ácidos grasos (FAS). Un equipo del Instituto Max Planck (MPI) de Ciencias Multidisciplinares, dirigido por Ashwin Chari y Holger Stark, ha visualizado ahora la estructura de la FAS con un detalle sin precedentes. Esto permite la observación directa de las reacciones enzimáticas y la reconstrucción de las transiciones estructurales dentro de un ciclo de síntesis de ácidos grasos. Los hallazgos abren nuevas vías para combatir los agentes infecciosos y prometen avances en biotecnología.
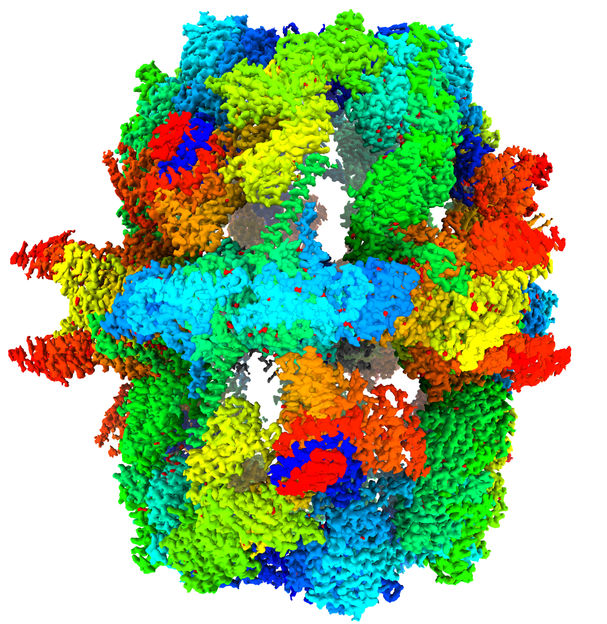
La imagen muestra la estructura de la sintasa de ácidos grasos de levadura a una resolución de 1,9 angstrom. El mapa de criomicroscopía electrónica se muestra en representación de superficie.
© Ashwin Chari / Max Planck Institute for Multidisciplinary Sciences

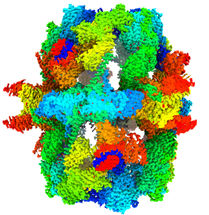
El mapa de criomicroscopía electrónica a 1,9 angstrom de resolución permite visualizar muchos detalles moleculares dentro de la sintasa de ácidos grasos. La fábrica molecular de ácidos grasos se representa en un gris-azul transparente, los puntos rojos dentro de la sintasa de ácidos grasos representan moléculas de agua modeladas y estructuradas.
© Ashwin Chari / Max Planck Institute for Multidisciplinary Sciences

Los seres humanos suelen ingerir la mayor parte de los ácidos grasos que necesitan a través de la dieta. Sin embargo, la biosíntesis de ácidos grasos es una vía metabólica vital. Para las levaduras y las bacterias, es incluso indispensable. La biosíntesis de ácidos grasos en levaduras y organismos superiores está catalizada por grandes complejos multiméricos de diferentes enzimas, mientras que las bacterias están representadas por proteínas individuales. Aunque la arquitectura de la maquinaria biosintética de ácidos grasos varía sustancialmente en los distintos organismos, las reacciones catalizadas y los módulos enzimáticos individuales se parecen entre sí.
Una visión detallada de la estructura y la química de la fábrica de ácidos grasos
Los equipos Max Planck dirigidos por Holger Stark, jefe del Departamento de Dinámica Estructural, y Ashwin Chari, jefe del grupo de investigación de Bioquímica Estructural y Mecanismos, han resuelto ahora la estructura tridimensional del FAS de levadura, por primera vez con una resolución sin precedentes: 1,9 angstroms, 19 millones de veces más pequeña que un milímetro. "En biología estructural, superar la barrera de los dos angstroms es esencial para comprender la química celular", explica el Director del Max Planck. "Revelamos las partes más internas del FAS y podemos observar tanto las reacciones enzimáticas como los detalles químicos de cómo interactúan las proteínas con moléculas pequeñas".
La combinación de bioquímica y criomicroscopía electrónica de alta resolución fue decisiva para el éxito de los científicos de Gotinga. Para sus experimentos utilizaron el microscopio electrónico de mayor resolución del mundo, capaz de resolver átomos individuales de una proteína.
Sin embargo, visualizar el FAS con gran precisión no basta para comprender su función. Al igual que su homólogo humano, el FAS fúngico sintetiza ácidos grasos en siete pasos de reacción individuales utilizando precursores químicos definidos de forma cíclica y repetitiva. Cada paso químico individual es realizado por un módulo enzimático independiente dentro del FAS. Por tanto, la cadena de ácidos grasos en crecimiento debe transportarse de un módulo enzimático a otro en una secuencia eficiente y ordenada. Una lanzadera molecular -la denominada proteína transportadora de acilo (ACP)- lleva a cabo esta importante tarea y orquesta la coreografía de las reacciones químicas necesarias para la biosíntesis de ácidos grasos.
Observación de la lanzadera molecular en acción
Los equipos de Stark y Chari también pudieron filmar el FAS en acción y reconstruir un ciclo completo de biosíntesis de ácidos grasos. Para ello, los investigadores utilizaron una combinación de métodos para seguir al ACP en su camino a través del laberinto del FAS. Inicialmente, iniciaron la biosíntesis de ácidos grasos en un tubo de ensayo y detuvieron su actividad congelando rápidamente las moléculas de FAS tras distintos periodos de tiempo. Esto permitió detener el FAS en distintos estados de biosíntesis de ácidos grasos. A continuación, el criomicroscopio electrónico captó instantáneas del ciclo del FAS. "Encontrar la combinación y las cantidades precisas de sustratos para detener el FAS en puntos críticos del ciclo de producción fue un gran reto técnico", explica Chari, jefe del grupo de investigación. "Sólo podemos reconstruir el ciclo completo de biosíntesis de ácidos grasos si todas las transiciones relevantes se visualizan y describen con precisión mediante modelos".
El siguiente paso fue la elucidación asistida por ordenador de las estructuras tridimensionales del FAS. Kashish Singh, primer autor del trabajo que ahora publica la revista Cell, explica el complejo procedimiento: "Desarrollamos procedimientos de procesamiento de imágenes que descomponen el FAS en compartimentos funcionales individuales. Después ordenamos las estructuras de forma que la secuencia de imágenes representara un ciclo de biosíntesis de ácidos grasos. Con la ayuda de estas instantáneas, por fin pudimos rastrear cómo interactúa la pequeña molécula ACP con determinados sitios del FAS y otras moléculas durante la producción de ácidos grasos."
Potencial para la medicina y la biotecnología
Meina Neumann-Schaal, Jefa de Departamento de la Colección Alemana de Microorganismos y Cultivos Celulares del Instituto Leibniz GmbH, informa de que esta molécula también tiene relevancia médica: "El ACP de la levadura FAS contiene una región estructural de la que carece su homólogo humano". Esto convierte a la molécula en un prometedor punto de partida para inhibir organismos patógenos que también utilizan el FAS de la levadura. Entre ellos figuran levaduras patógenas como Candida albicans, que infecta las mucosas, así como micobacterias, el agente infeccioso subyacente a la tuberculosis. Dado que la tuberculosis multirresistente sigue constituyendo un reto para el éxito del tratamiento, existe una necesidad urgente de nuevos inhibidores.
Otro hallazgo de la investigación podría utilizarse para avances biotecnológicos. Los equipos de Chari y Stark han demostrado que es posible incorporar módulos enzimáticos adicionales al FAS para modificar su actividad. "Con una actividad normal, el FAS produce una mezcla de ácidos grasos de cadena corta y larga. En el futuro, podría utilizarse un FAS personalizado para producir ácidos grasos de la longitud de cadena deseada", afirma Chari. Éstos son necesarios en la industria química para producir, entre otras cosas, cosméticos, jabones y aromatizantes. También son componentes básicos de productos farmacéuticos y biocombustibles. Los equipos de investigación de Gotinga también ven la oportunidad de producir ácidos grasos de forma sostenible utilizando fábricas biosintéticas de FAS específicamente modificadas, en lugar de extraerlos del petróleo crudo o del aceite de palma, como se hace actualmente.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.