Un nuevo "radar" detecta los destructores celulares activos
El estudio proporciona una visión sin precedentes de los actores implicados en los cambios dinámicos de nuestro equilibrio proteico
Nuestras células cuentan con una flota de 300 máquinas moleculares, llamadas cullin-RING ligasas, o "CRLs" para abreviar, que son capaces de desencadenar la destrucción de proteínas específicas para el bienestar de nuestras células. Sin embargo, la mayoría de las proteínas son necesarias, por lo que sólo deben destruirse aquellas que bloquean nuevas vías celulares necesarias o que son tóxicas. El potencial destructivo de los CRL está estrechamente controlado. Los CRL se activan sólo temporalmente, cuando es necesario. Investigadores del MPI de Bioquímica y de la Universidad de Waterloo han desarrollado una nueva forma de detectar los CRLs de la flota que están "encendidos", lo que revela los CRLs desplegados para resolver tensiones celulares y realizar las acciones de algunos fármacos anticancerígenos.
Las células del cuerpo humano deben adaptar su equilibrio proteico a determinadas situaciones, como la disponibilidad de hierro o una infección. Estas adaptaciones se producen a través de un complejo proceso, en el que las proteínas que ya no son necesarias o que son tóxicas se marcan para su destrucción uniéndoles una pequeña proteína llamada ubiquitina. Este marcado de una proteína para su destrucción mediante la ubiquitina lo llevan a cabo las ligasas Cullin-RING, o "CRL" para abreviar. Por tanto, las CRL pueden considerarse "destructoras" de moléculas proteicas específicas.
En conjunto, las CRL son la mayor colección de máquinas de etiquetado de ubiquitina, con más de 300 miembros. El primer autor, Lukas Henneberg, explica: "Se puede imaginar que los 300 CRL diferentes dentro de una célula son como una flota de destructores, cada uno de los cuales sería capaz de fijarse en un objetivo diferente. Si una célula se expone a un aumento de hierro o a bacterias infecciosas, hay que destruir las proteínas que aumentarían aún más el hierro hasta niveles tóxicos o que impedirían que la respuesta inmunitaria curase la infección. Tales proteínas son el objetivo de los destructores de CRL". Pero se desconoce cuáles de las 300 CRL diferentes están implicadas en la adaptación a muchas condiciones celulares diferentes, porque hasta ahora ha sido un reto detectar qué destructoras específicas de la flota están activadas en un momento dado.
¿Qué máquinas moleculares ligasa Cullin-RING están activas y cuándo?
La flota de CRLs navega esencialmente por el mar que es el interior de la célula, y cada una de ellas espera individualmente una señal de que es necesaria. Cuando se produce la señal, el CRL necesario se activa temporalmente mediante la unión de otra proteína, llamada NEDD8. En cuanto la acción destructiva del LCR deja de ser necesaria, el LCR se apaga mediante la eliminación de NEDD8.
Los investigadores de los laboratorios de Brenda Schulman, del Instituto Max Planck (MPI) de Bioquímica, y Sachdev Sidhu, de la Universidad de Waterloo, han desarrollado el primero de un método de dos pasos para detectar qué CRL están unidos a NEDD8 y, por tanto, activados.
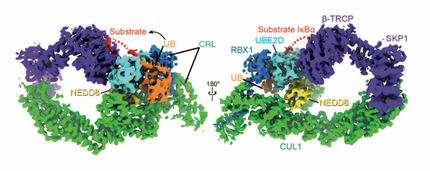
Produjeron un anticuerpo sintético que reconoce las CRL-moleculares-máquinas unidas a NEDD8. Los investigadores determinaron una estructura cristalina, esencialmente una fotografía molecular en 3D, que muestra cómo el anticuerpo puede capturar NEDD8 unido a casi todos los CRL, sólo cuando un CRL se enciende para permitir que se destruya el etiquetado de ubiquitina de las proteínas. Así, el anticuerpo sintético es una sonda basada en la actividad, o un "radar molecular", que puede detectar qué CRLs se activan para etiquetar sus proteínas diana para su destrucción.
A continuación, los científicos de los departamentos de Brenda Schulman y Matthias Mann del MPI de Bioquímica desarrollaron el segundo paso del nuevo método para averiguar cuáles de toda la flota de CRL se activan en condiciones celulares normales y cuáles se activan para adaptarse a las necesidades celulares cambiantes. Las máquinas moleculares CRL unidas al anticuerpo, es decir, las activas, se extrajeron de las células y se recogieron para utilizar espectrometría de masas de última generación con el fin de medir cuáles y cuántas CRL estaban activas en las células en un momento determinado.
Las ligasas Cullin-RING en la medicina farmacéutica
En el estudio actual, los autores pudieron identificar qué CRL se activan en respuesta al hierro y cuáles se activan por signos celulares de inflamación. Los autores también estudiaron las CRL que se activan por la acción de los llamados fármacos "degradadores". Estos fármacos son terapias que hacen que un LCR se dirija a una proteína patógena para destruirla. Por ahora, los fármacos degradadores se utilizan para tratar algunos tipos de cáncer, aunque el concepto se está investigando para otras enfermedades. El nuevo método demostró que la cantidad disponible de ciertos LCR varía en los distintos tipos de células, lo que influye en la eficacia de los fármacos degradadores. Cuanto mayor sea la cantidad del "destructor" CRL ya activada en una célula, más rápido podrá una molécula degradadora hacer que se elimine la proteína causante de la enfermedad.
Las ligasas Cullin-RING y nuestro sistema inmunitario
Los investigadores también colaboraron con el laboratorio de Peter Murray en el MPI de Bioquímica para estudiar las CRL activas en unas células llamadas macrófagos. Los macrófagos son tipos específicos de células de las que depende nuestro sistema inmunitario para diferentes funciones curativas. La comparación de las moléculas CRL activas de los macrófagos especializados en la lucha contra las bacterias con las de los macrófagos especializados en la cicatrización de heridas reveló claras diferencias que sugieren los tipos de adaptaciones necesarias para que las células macrófagas realicen estas funciones tan diferentes.
Los hallazgos de este estudio proporcionan una mirada sin precedentes a los actores implicados en los cambios dinámicos de nuestro equilibrio proteico y su implicación en estados fisiopatológicos, lo que puede guiar el uso de las CRL en el desarrollo de nuevas terapias en el futuro.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Lukas T. Henneberg, Jaspal Singh, David M. Duda, Kheewoong Baek, David Yanishevski, Peter J. Murray, Matthias Mann, Sachdev S. Sidhu & Brenda A. Schulman, Activity-based profiling of cullin–RING E3 networks by conformation-specific probes. Nature Chemical Biology, August 2023