Atraer al virus a una trampa
Los investigadores describen mecanismos que podrían ayudar a prevenir las infecciones por los virus de la gripe A y el ébola
Los virus como el de la gripe A y el Ébola invaden las células humanas siguiendo una serie de pasos. En un planteamiento interdisciplinar, equipos de investigación de la Universidad de Heidelberg y el Hospital Universitario de Heidelberg investigaron las etapas finales de la penetración viral mediante tomografía electrónica y simulaciones por ordenador. En el caso de la gripe A, pudieron determinar cómo el sistema inmunitario combate el virus mediante una pequeña proteína. En el caso de los virus del Ébola, descubrieron que una estructura proteínica específica debe desmontarse para que la infección se arraigue. Los llamados poros de fusión, a través de los cuales el genoma vírico se libera en la célula huésped, desempeñan un papel central en estos procesos. Si se impide su formación, también se bloquea el virus. Los científicos de Heidelberg describen mecanismos desconocidos hasta ahora, que podrían conducir a nuevos enfoques para prevenir las infecciones.
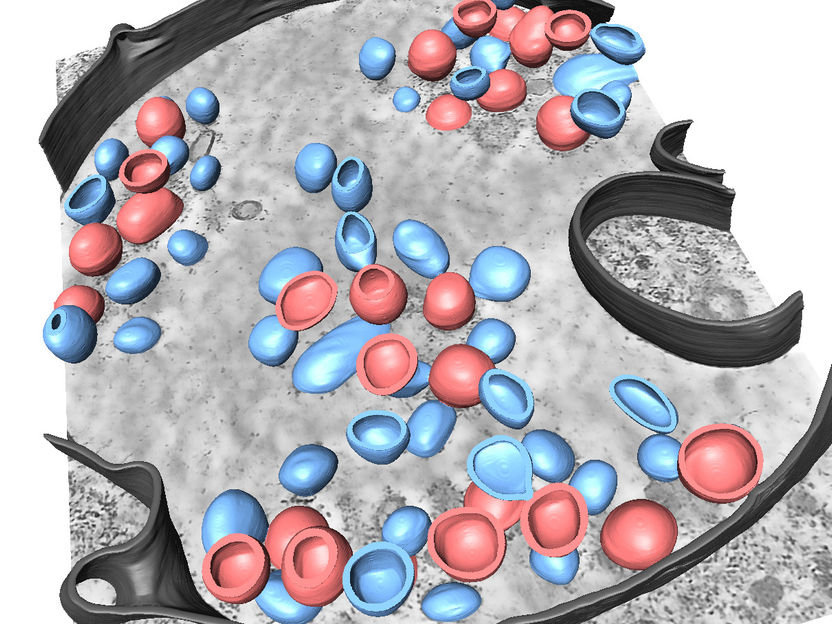
Segmentación en 3D de diferentes estructuras relacionadas con una infección por el virus de la gripe A.
Petr Chlanda
Muchos de los virus que infectan al ser humano están recubiertos por una membrana lipídica con glicoproteínas que pueden acoplarse a las células humanas. En virus como el de la gripe A, que penetran a través de las vías respiratorias, estas proteínas son las que se unen principalmente a las células epiteliales de la nariz y los pulmones. En cambio, el virus del Ébola, altamente infeccioso, se propaga por contacto directo con fluidos corporales infectados y puede penetrar en un amplio espectro de tipos celulares. Tras invadir las células humanas, estos virus deben abrir un poro de fusión entre la membrana del virus y la del huésped para liberar su genoma en la célula huésped y propagarse.
Para combatir el virus, el sistema inmunitario humano intenta bloquear la formación del poro de fusión en un proceso de varias etapas. Las células infectadas detectan la presencia del genoma extraño y envían una señal, en forma de molécula de interferón, a las células aún no infectadas. Esta señal hace que las células no infectadas produzcan una pequeña proteína celular llamada proteína transmembrana inducida por interferón 3 (IFITM3). "Esta proteína especializada puede impedir eficazmente la penetración de virus como el de la gripe A, el SARS-CoV-2 y el Ébola, pero se desconocían los mecanismos subyacentes", afirma el virólogo Dr. Petr Chlanda, cuyo grupo de trabajo pertenece al Centro BioQuant de la Universidad de Heidelberg y al Centro de Investigación Integrativa de Enfermedades Infecciosas del Hospital Universitario de Heidelberg. Los investigadores han podido demostrar ahora que, en el caso de los virus de la gripe A, el IFITM3 ordena selectivamente los lípidos de la membrana a nivel local. Esto impide que se formen los poros de fusión. "Los virus quedan literalmente atrapados en una trampa lipídica. Nuestra investigación indica que acaban siendo destruidos", explica el Dr. Chlanda.
Para analizar los detalles estructurales de los virus, el Dr. Chlanda y su equipo aprovecharon el equipo de la Red de Microscopía Crioelectrónica de Ruperto Carola. En un enfoque interdisciplinario, los grupos de investigación dirigidos por el Prof. Dr. Ulrich Schwarz, del BioQuant-Center y del Instituto de Física Teórica, junto con el Prof. Dr. Walter Nickel, del Centro de Bioquímica de la Universidad de Heidelberg, predijeron este proceso con ayuda de simulaciones por ordenador. En el contexto de la terapia antiviral, los investigadores creen que es posible desarrollar péptidos clasificadores de lípidos que se inserten en la membrana del virus, incapacitándolo para la fusión de membranas. "Tales péptidos podrían utilizarse, por ejemplo, en un aerosol nasal", afirma Petr Chlanda.
En un segundo estudio, los investigadores de Heidelberg estudiaron la penetración y fusión del virus del Ébola. La morfología filamentosa del virus viene determinada por una envoltura proteica flexible conocida como capa de proteína matriz VP40. "Siempre nos ha intrigado cómo este virus tan largo podía penetrar en la célula, fusionarse con la membrana y liberar su genoma", afirma el Dr. Chlanda. Gracias a su análisis estructural de células infectadas pero inactivas, facilitado por colaboradores del Instituto Friedrich Loeffler de Greifswald, los investigadores descubrieron que esta envoltura proteica del virus se desensambla a pH bajo, es decir, en un entorno ácido. Este paso no es el menos decisivo para la formación de poros de fusión, como demostraron otras simulaciones por ordenador realizadas por los profesores Schwarz y Nickel. Durante este proceso, las interacciones electrostáticas de la matriz VP40 con la membrana se debilitan, reduciendo así la barrera energética de la formación de poros. Los resultados de la investigación básica de Heidelberg sugieren que el bloqueo del desmontaje de esta capa sería una forma de mantener los virus del Ébola en un estado que no permita la formación de poros de fusión. Al igual que ocurre con el virus de la gripe A, el virus del Ébola caería en una trampa de la que no podría escapar.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
S. Winter, G. Golani, F. Lolicato, M. Vallbracht, K. Thiyagarajah, S. Sid Ahmed, C. Lüchtenborg, O. Fackler, B. Brügger, T. Hoenen, W. Nickel, Ulrich Schwarz, P. Chlanda: The Ebola virus VP40 matrix layer undergoes endosomal disassembly essential for membrane fusion. EMBO Journal e113578 (21 April 2023)









































