Las gotas de proteínas pueden causar muchos tipos de enfermedades genéticas
El mal funcionamiento de los condensados celulares es un mecanismo patológico relevante en malformaciones congénitas, enfermedades comunes y cáncer.
La mayoría de las proteínas se localizan en distintas gotas ricas en proteínas en las células, también conocidas como "condensados celulares". Estas proteínas contienen secuencias que funcionan como etiquetas que indican a la proteína a qué condensado debe dirigirse. Cuando las etiquetas se confunden, las proteínas pueden acabar en el condensado equivocado. Según un equipo internacional de investigadores de medicina clínica y biología básica, ésta podría ser la causa de muchas enfermedades sin resolver. Los resultados aparecen en la revista Nature.
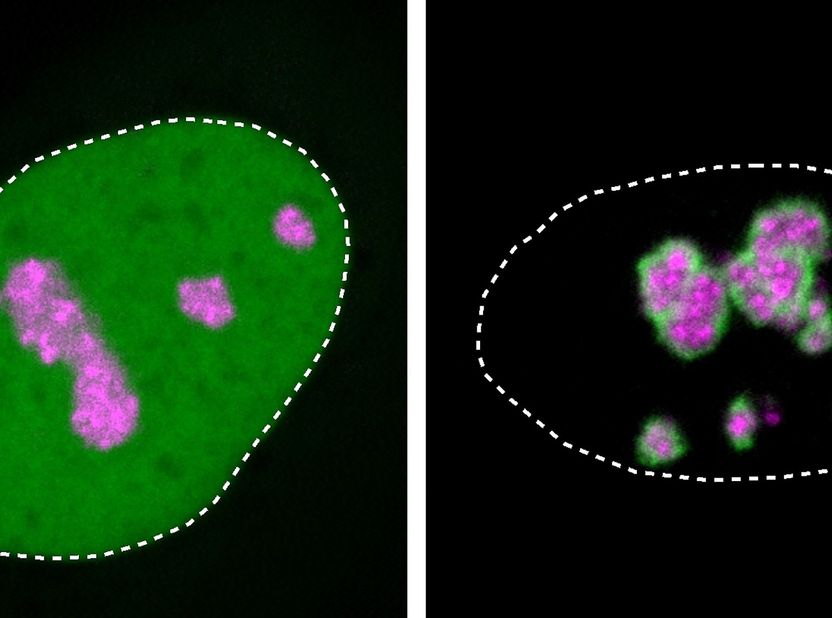
Primer plano de núcleos celulares en un cultivo de células humanas: La proteína HMGB1 (verde) suele encontrarse en todo el núcleo (línea de puntos). La HMGB1 mutante, mostrada a la derecha, se localiza preferentemente en el nucléolo (marcado en magenta) y forma una capa solidificada sobre él, lo que causa la enfermedad.
Henri Niskanen, MPIMG
Los pacientes con síndrome de BPTA presentan una malformación característica de las extremidades, con dedos cortos y adicionales, ausencia de huesos tibiales en las piernas y tamaño reducido del cerebro. Según descubrieron los investigadores, el BPTAS está causado por un cambio genético especial que hace que una proteína esencial migre al nucléolo, una gran gota proteínica del núcleo celular. Como resultado, se inhibe la función del condensado nucleolar y se desarrolla la enfermedad.
"Lo que hemos descubierto en esta enfermedad podría aplicarse a muchos otros trastornos. Es probable que no se trate de un raro unicornio que sólo existe una vez. Hasta ahora no habíamos visto el fenómeno porque no sabíamos cómo buscarlo", afirma Denise Horn, genetista clínica del Instituto de Genética Médica y Humana de la Charité - Universitätsmedizin Berlin.
En colaboración con científicos del Instituto Max Planck de Genética Molecular (MPIMG) de Berlín, el Hospital Universitario de Schleswig-Holstein (UKSH) y colaboradores de todo el mundo, el equipo está abriendo una puerta a nuevos diagnósticos que podrían conducir al esclarecimiento de otras muchas enfermedades, así como a posibles terapias futuras.
"Hemos descubierto un nuevo mecanismo que podría estar en juego en una amplia gama de enfermedades, incluidas las hereditarias y el cáncer", afirma Denes Hnisz, Jefe del Grupo de Investigación del MPIMG. "De hecho, hemos descubierto más de 600 mutaciones similares, 101 de las cuales se sabe que están asociadas a distintos trastornos".
"El trabajo real no ha hecho más que empezar ahora", añade el genetista humano Malte Spielmann, del UKSH de Lübeck y Kiel. "Encontraremos muchos más genes con este tipo de mutaciones causantes de enfermedades y ahora podremos comprobar su modo de acción".
Una mutación inusual
Los individuos afectados presentan malformaciones complejas y llamativas de las extremidades, la cara y los sistemas nervioso y óseo, sólo parcialmente descritas por el ya largo nombre de la enfermedad "síndrome de braquifalangia-polidactilia-aplasia/ hipoplasia tibial" (BPTAS).
"Con menos de diez casos documentados en todo el mundo, la enfermedad no sólo es rara, sino ultrarrara", afirma Martin Mensah, genetista clínico del Instituto de Genética Médica y Humana de Charité. Para rastrear la causa, él y sus colegas descodificaron el genoma de cinco individuos afectados y descubrieron que el gen de la proteína HMGB1 estaba alterado en todos los pacientes.
Esta proteína se encarga de organizar el material genético en el núcleo celular y facilita la interacción de otras moléculas con el ADN, por ejemplo para leer genes.
En ratones, la pérdida completa del gen en ambos cromosomas es catastrófica y conduce a la muerte del embrión. Sin embargo, en algunos pacientes con sólo una copia mutada, las células utilizan la copia intacta en el otro cromosoma, lo que sólo provoca un leve retraso en el desarrollo neurológico. Pero los casos recién descubiertos no se ajustaban a este esquema.
"Los cinco individuos no emparentados presentaban el mismo trastorno ultra-raro y tenían prácticamente la misma mutación", dice Mensah, que es miembro del Programa de Científicos Clínicos operado por el Instituto de Salud de Berlín en Charité (BIH) y Charité. "Por eso estamos seguros de que la mutación HMGB1 es la causa de la enfermedad. Sin embargo, en ese momento, no teníamos ni idea de cómo el producto génico causaba funcionalmente la enfermedad, sobre todo teniendo en cuenta que las mutaciones de pérdida de función daban lugar a otros fenotipos."
Extensiones de proteínas cargadas
Un examen más detallado reveló que las distintas mutaciones de HMGB1 tienen consecuencias diferentes. Los datos de secuenciación mostraron que en los individuos afectados con las malformaciones graves, el marco de lectura del tercio final del gen HMGB1 está desplazado.
Tras la traducción a proteína, la región correspondiente ya no está dotada de bloques constructores de aminoácidos con carga negativa, sino positiva. Esto puede ocurrir si en la secuencia falta un número de letras genéticas no divisible por tres, porque exactamente tres letras consecutivas siempre codifican un bloque constructor de la proteína.
Sin embargo, la cola de la proteína no tiene una estructura definida. En su lugar, esta sección cuelga de la molécula como una goma elástica suelta. Las finalidades de estas colas de proteínas (también llamadas "regiones intrínsecamente desordenadas") son difíciles de estudiar porque a menudo sólo se hacen efectivas en conjunción con otras moléculas. Entonces, ¿cómo puede su mutación provocar la enfermedad observada?
Gotitas de proteína en la célula
Para responder a esta pregunta, los investigadores médicos se dirigieron a los bioquímicos Denes Hnisz y Henri Niskanen del MPIMG, que trabajan con condensados celulares que controlan genes importantes. Estas estructuras en forma de gota se comportan de manera muy parecida a las gotitas de aceite y vinagre de un aliño de ensalada. Compuestas por un gran número de moléculas diferentes, están separadas de su entorno y pueden sufrir cambios dinámicos.
"Creemos que los condensados se forman en la célula por razones prácticas", explica Niskanen. Las moléculas destinadas a una tarea específica se agrupan de este modo, por ejemplo para leer un gen. Sólo para esta tarea, dice, varios cientos de proteínas necesitan abrirse camino de algún modo hasta el lugar correcto.
"Se cree que las regiones intrínsecamente desordenadas, que no suelen tener una función bioquímica obvia, son las responsables de la formación de condensados", dice Niskanen, poniendo un ejemplo para describir lo importantes que son a este respecto las propiedades físicas de las extensiones de las proteínas. "Puedo hacer fácilmente una bola con muchas gomas elásticas sueltas que se mantenga unida con relativa firmeza y que pueda desmontarse con poco esfuerzo. En cambio, una bola de hilo de pescar liso o de cinta adhesiva se comportaría de forma muy distinta."
Gotas solidificantes
El nucléolo dentro del núcleo celular también es un condensado, que aparece como una mancha oscura difusa al microscopio. Aquí es donde muchas proteínas con colas cargadas positivamente prefieren quedarse. Muchas de ellas proporcionan la maquinaria necesaria para la síntesis de proteínas, por lo que este condensado es esencial para las funciones celulares.
La proteína mutante HMGB1, con su cola molecular cargada positivamente, también se siente atraída por el nucléolo, como observó el equipo a partir de experimentos con proteína aislada y con cultivos celulares.
Pero como la región mutada de la proteína también ha ganado una parte aceitosa y pegajosa, tiende a aglutinarse. El nucléolo pierde sus propiedades fluidas y se solidifica cada vez más, lo que Niskanen pudo observar al microscopio. Esto perjudicaba las funciones vitales de las células: con la proteína mutada, morían más células en un cultivo en comparación con un cultivo de células sin la mutación.
Búsqueda en bases de datos
A continuación, el equipo de investigación buscó incidentes similares en las bases de datos genómicos de miles de individuos. De hecho, los científicos lograron identificar más de seiscientas mutaciones similares en 66 proteínas, en las que el marco de lectura se había desplazado por una mutación en la cola de la proteína, haciéndola a la vez más cargada positivamente y más "grasienta". De las mutaciones, 101 se habían relacionado previamente con diversos trastornos.
Para un ensayo de cultivo celular, el equipo seleccionó 13 genes mutantes. En 12 de los 13 casos, las proteínas mutantes tenían preferencia por localizarse en el nucleolo. Aproximadamente la mitad de las proteínas analizadas alteraban la función del nucléolo, lo que se asemeja al mecanismo de la enfermedad del síndrome BPTA.
Nuevas explicaciones para enfermedades existentes
"Para la investigación clínica, nuestro estudio podría tener un efecto revelador", afirma Malte Spielmann, que dirigió la investigación junto con Denes Hnisz y Denise Horn. "En el futuro, sin duda podremos dilucidar las causas de algunas enfermedades genéticas y, con suerte, tratarlas algún día".
Sin embargo, "las enfermedades genéticas congénitas como el BPTAS son casi imposibles de curar incluso con nuestros nuevos conocimientos", afirma Horn. "Como las malformaciones ya se desarrollan en el útero, habría que tratarlas con fármacos antes de que se desarrollen. Esto sería muy difícil de hacer".
Pero las enfermedades tumorales también están determinadas predominantemente por la genética, añade Hnisz: "Los condensados celulares y la separación de fases asociada son un mecanismo fundamental de la célula que también desempeña un papel en el cáncer. Las posibilidades de desarrollar terapias específicas para esto son mucho mayores".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.