Uso de nanoporos para detectar más rápidamente los cambios epigenéticos
Un paso hacia la optimización del diagnóstico médico
Los cambios conocidos como modificaciones epigenéticas desempeñan un importante papel en el desarrollo del cáncer, entre otras cosas. Poder analizarlos de forma rápida y fiable podría, por ejemplo, contribuir significativamente al desarrollo de una terapia personalizada. Un equipo de investigación del Instituto de Fisiología de la Universidad de Friburgo ha logrado caracterizar los cambios químicos en las proteínas que son típicos de las modificaciones epigenéticas mediante el análisis de nanoporos. Los investigadores han publicado los resultados de su investigación en el Journal of the American Chemical Society (JACS).
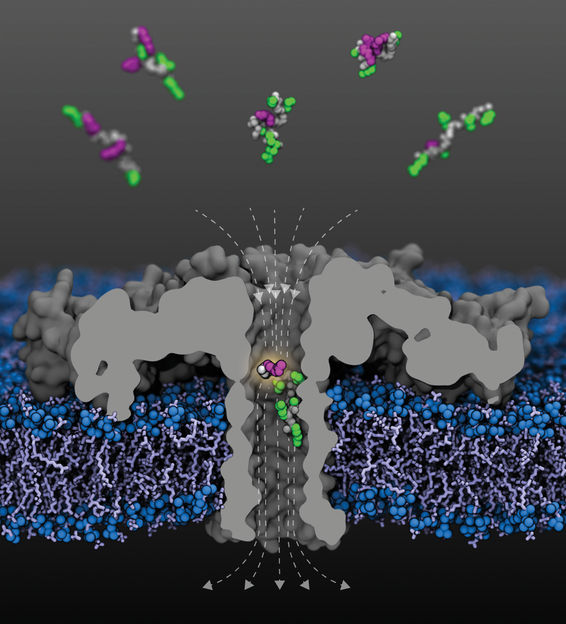
Vista abierta del poro de la aerolisina modificada (R220S) (gris) con líneas de campo (punteadas) en una membrana lipídica. Fragmentos de la proteína histona humana 4 acetilados en varios residuos de lisina llegan desde el compartimento superior; se muestra un fragmento acetilado en lisina-8 dentro del poro. Las columnas vertebrales del péptido se muestran en gris, las cadenas laterales no modificadas en verde y las lisinas acetiladas en morado.
Sarthak Kumar, University of Illinois at Urbana-Champaign
En los últimos años, los nanoporos se han convertido en una herramienta ampliamente aplicable para el análisis de moléculas. Gracias a sus propiedades especiales, permiten analizar la estructura de las moléculas en fracciones de segundo: como proteínas dispuestas de forma cilíndrica, los nanoporos forman canales diminutos de sólo unas millonésimas de milímetro (nanómetro) de diámetro que pueden incrustarse en biomembranas. "Para los experimentos, aplicamos un voltaje constante a través de la membrana para que los iones del medio circundante fluyan a través del poro. Así se crea una corriente eléctrica constante y medible con precisión", explica el Prof. Dr. Jan C. Behrends, de la Facultad de Medicina de la Universidad de Friburgo, en cuyo laboratorio se realizaron los experimentos ahora publicados. Sin embargo, cuando una molécula migra hacia el poro, la corriente se bloquea: cuanto más grande es la molécula, más fuertemente se bloquea también.
Una proteína en el punto de mira de la investigación: H4
En el marco de los experimentos ahora publicados, los científicos de Friburgo se dedicaron a la investigación de la llamada proteína histona H4. Esta proteína está firmemente asociada al ADN en todas las células con núcleo y es uno de los objetivos mejor investigados de las modificaciones epigenéticas. Una región en el extremo N-terminal de la proteína se ve especialmente afectada por estas modificaciones. "La secuencia de la proteína contiene el aminoácido lisina varias veces", explica Behrends. A estas lisinas, que se denominan K8, K12 y K16 según su posición en la cadena de la proteína, pueden unirse grupos acetilos o metilos, por ejemplo, como parte de las modificaciones epigenéticas. Qué modificación química tiene lugar en qué posición de la lisina es definitivamente de importancia médica, como señala el fisiólogo de Friburgo. "La acetilación en K16, por ejemplo, es importante para el desarrollo humano, mientras que la metilación en K12 desempeña un papel en el desarrollo de algunos tumores de próstata y pulmón, según los últimos resultados del Centro Médico - Universidad de Friburgo".
Detección de cambios con la ayuda de un nanoporo
En sus experimentos, Behrends y su equipo pudieron distinguir claramente los fragmentos H4 con o sin acetilación, así como los fragmentos con una, dos o tres acetilaciones. Además, consiguieron demostrar que el nanoporo que utilizaron también era sensible al lugar de acetilación: los fragmentos de histona con un grupo acetil en K8 bloqueaban la corriente a través del poro con más fuerza que los acetilados en K12, y éstos a su vez con más fuerza que los que tenían una acetilación en K16. "Este tipo de sensibilidad es sorprendente, ya que estos fragmentos son idénticos en cuanto a su masa y volumen total", afirma Behrends. Así, la corriente de poros parece ser sensible no sólo al tamaño, sino también a la forma de la molécula. Fue igualmente fácil distinguir entre las diferentes variantes de fragmentos de histona doblemente acetilados - K8 y K12, K8 y K16, y K12 y K16 - de nuevo, a pesar de la masa idéntica. Los fragmentos H4 metilados en diferentes grados y posiciones también bloquearon la corriente a través del poro en diferentes grados, aunque no tan claramente como las variantes acetiladas.
"Hemos podido demostrar por primera vez mediante nuestros experimentos que el análisis de nanoporos permite distinguir las moléculas no sólo por su tamaño, sino también por su forma", resume Behrends, líder del estudio. Las simulaciones de dinámica molecular realizadas por el grupo de investigación dirigido por Aleksei Aksimentiev, de la Universidad de Illinois (EE.UU.) -que también participa en el estudio-, demuestran que un campo eléctrico altamente inhomogéneo en el interior del poro desempeña un papel fundamental en este efecto.
Visión de futuro: diagnóstico médico optimizado
Mientras que la secuenciación del ADN mediante nanoporos ya está consolidada y comercializada, el desarrollo del análisis de proteínas basado en nanoporos no ha hecho más que empezar, subraya Behrends. "La dificultad de la secuenciación de proteínas es que se trata de moléculas con patrones de carga muy poco uniformes". Mientras que el ADN, que está cargado negativamente, migra direccionalmente en el campo eléctrico y, por lo tanto, puede ser arrastrado a través del poro base por base, las proteínas consisten en bloques de construcción formados por los aminoácidos con diferentes cargas. En consecuencia, no es posible el movimiento dirigido en el campo eléctrico y el "barrido" aminoácido por aminoácido. Por ello, los científicos de Friburgo recurrieron a un enfoque diferente para sus experimentos. En lugar de un poro con una constricción corta, como se utiliza en la secuenciación del ADN, utilizaron un poro hecho a medida con una especie de trampa molecular. "Esto permitió capturar todo el fragmento de proteína a la vez", dice Behrends.
Todavía no está claro hasta qué tamaño de fragmento puede utilizarse este tipo de análisis. Sin embargo, los experimentos adicionales muestran que el método también será adecuado para el análisis de los fragmentos H4 utilizados anteriormente en la investigación epigenética. Éstos contienen 14 aminoácidos en lugar de los diez utilizados aquí, y actualmente se investigan las modificaciones epigenéticas con la espectrometría de masas en tándem, una técnica muy elaborada. Los investigadores esperan que los nanoporos hagan que el análisis sea mucho más sencillo, rápido y rentable, y que pueda llevarse a cabo cerca del paciente.
El desarrollo ulterior del análisis de proteínas por nanoporos para el diagnóstico médico y su aplicación en productos y servicios concretos es también uno de los proyectos centrales del recientemente aprobado Cluster4Future nanodiagBW del BMBF, que Behrends dirige junto con el Prof. Dr. Felix von Stetten, de la Hahn-Schickard-Gesellschaft, que lidera este proyecto.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.