Agentes dobles: Cómo las células madre del estómago cambian de lealtad tras una lesión
Las células madre adultas son más complejas de lo que se pensaba
Una población de células madre adultas del estómago puede cumplir dos funciones distintas: ayudar a la digestión en condiciones normales o tomar la iniciativa en la respuesta a las lesiones. Los científicos del IMBA, Instituto de Biotecnología Molecular de la Academia Austriaca de Ciencias, demuestran que estas funciones son las dos caras de una moneda. En caso de lesión, basta un "interruptor molecular" para que las células madre pasen de un estado a otro. Los hallazgos, publicados ahora en Cell Stem Cell, podrían ser decisivos para mejorar nuestra comprensión de las patologías gástricas.
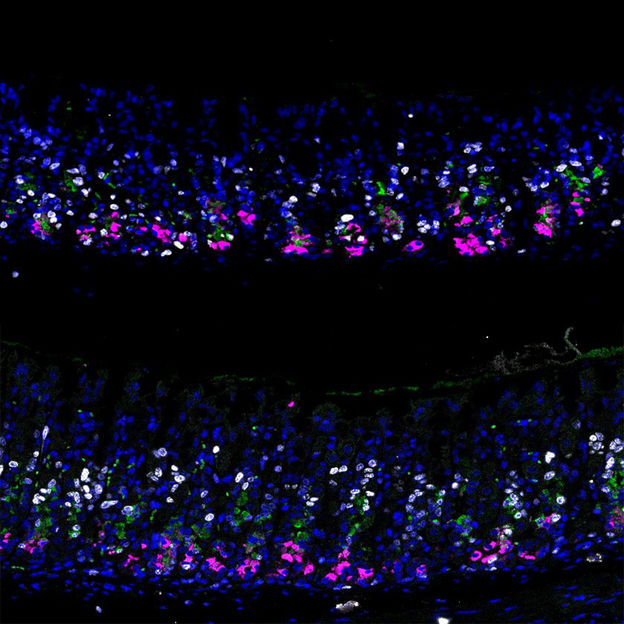
Epitelio normal del estómago del ratón frente a la sobreexpresión de p57 dpi3
©Lee/Koo/CellStemCell/IMBA
El interés de los científicos por las células madre adultas reside en su capacidad de autorrenovación indefinida y de diferenciarse en todos los tipos celulares que componen el órgano donde residen. Cada vez hay más pruebas de que éstas no son las únicas funciones de las células madre adultas. Algunas también pueden desempeñar un papel clave en el funcionamiento normal de los órganos, un fenómeno denominado "homeostasis", al tiempo que mantienen su capacidad de regenerar tejidos dañados cuando lo necesitan. Por lo tanto, las células madre adultas son más complejas de lo que podríamos pensar, y puede que sólo estemos empezando a arañar la superficie de su diversidad funcional y versatilidad.
Una población específica de células madre adultas en el cuerpo del estómago se denomina "células jefe". Estas células actúan como "células madre de reserva" en condiciones fisiológicas normales, lo que significa que no se dividen sino que sólo segregan enzimas digestivas. Sin embargo, en caso de daño tisular, las células pasan repentinamente a un estado de rápida proliferación y regeneran el tejido dañado. "Sabíamos que este comportamiento debía depender de un interruptor, y nos propusimos desvelar el mecanismo preciso de este cambio", afirma el jefe de grupo del IMBA, Bon-Kyoung Koo, autor correspondiente del estudio.
Los investigadores idearon un sólido plan de acción para responder a sus preguntas. Junto con colaboradores del Centro Médico de la Universidad de Vanderbilt, en Nashville (EE.UU.), y de la Universidad de Ciencia y Tecnología de Pohang (POSTECH), en la República de Corea, desarrollaron un modelo de ratón para rastrear los efectos de la lesión del tejido estomacal a nivel unicelular. De este modo, el equipo pudo caracterizar todos los genes transcritos a nivel unicelular (un enfoque denominado "análisis del transcriptoma") y rastrear el linaje de las células en el tejido estomacal regenerado del ratón. "Con esta estrategia, identificamos una molécula, p57, como el posible interruptor molecular que habíamos estado buscando", afirma Ji-Hyun Lee, autor principal y becario posdoctoral del laboratorio de Koo en el IMBA. "Confirmamos que, tras la lesión, el nivel de p57 disminuye rápidamente en las células principales y que a esto le sigue un pico de proliferación dentro del linaje de células principales", continúa.
Para poner a prueba su hipótesis y reforzar sus hallazgos, el equipo sobreexpresó p57 en organoides de estómago. Esto les permitió inducir un estado de células madre de reserva a largo plazo en los organoides y un mayor nivel de secreción de enzimas. En otras palabras, los altos niveles de p57 en los organoides hicieron que las células madre de reserva se comportaran más como células principales maduras y secretoras, que no proliferan. "Los organoides suelen ser muy proliferativos debido al cóctel de factores de crecimiento que necesitan en el cultivo. Sin embargo, en cuanto introdujimos p57, los organoides dejaron de crecer de repente", explica Lee. "En un segundo paso, redujimos la expresión de p57 y, para nuestra alegría, los organoides volvieron a proliferar", prosigue antes de resumir: "Esto significa que las células no perdieron su carácter de madre debido a p57. Simplemente pasaron a un estado de reserva, imitando exactamente nuestras observaciones in vivo".
La molécula p57 pertenece a una familia más amplia de proteínas, los llamados inhibidores de las CDK, que inhiben el ciclo celular y la proliferación. Se han desarrollado fármacos con esta función para tratar algunos tipos de cáncer. Por ello, el equipo dirigido por Koo y Lee probó el efecto de otras moléculas de esta familia en los organoides estomacales para comprobar si sus hallazgos eran realmente específicos de p57. A diferencia de p57, las otras moléculas no indujeron un estado reversible de células madre de reserva en los organoides, sino que simplemente los hicieron morir. "Nuestros hallazgos demuestran que p57 es un guardián que impone el estado de células madre de reserva de las células principales del estómago en la homeostasis", resume Koo, confirmando que p57 es efectivamente el interruptor molecular que habían estado buscando.
Los hallazgos podrían tener un impacto importante en la comprensión de las patologías gástricas. Lee menciona una de esas patologías conocidas, la Metaplasia Expresiva de Polipéptidos Espasmolíticos (SPEM), una afección crónica que se sabe que es premaligna, o que podría desembocar en un cáncer. "Aunque la SPEM es una afección crónica y nuestro montaje experimental sólo nos permite comprobar los efectos de una lesión aguda, ahora creemos que la SPEM deriva de las células principales del estómago. Por tanto, comprender la activación de estas células nos ayuda a entender los mecanismos moleculares subyacentes del SPEM", concluye Lee.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.