Comienza una nueva era de edición del genoma mitocondrial
Los científicos consiguen convertir las bases A en G, la última pieza del rompecabezas que faltaba en la tecnología de edición de genes
Investigadores del Centro de Ingeniería Genómica del Instituto de Ciencias Básicas desarrollaron una nueva plataforma de edición de genes denominada deaminasas ligadas a efectores similares a activadores de la transcripción, o TALED. Las TALED son editores de bases capaces de realizar la conversión de bases A a G en las mitocondrias. Este descubrimiento fue la culminación de un viaje de décadas para curar las enfermedades genéticas humanas, y el TALED puede considerarse la última pieza que faltaba en el rompecabezas de la tecnología de edición de genes.
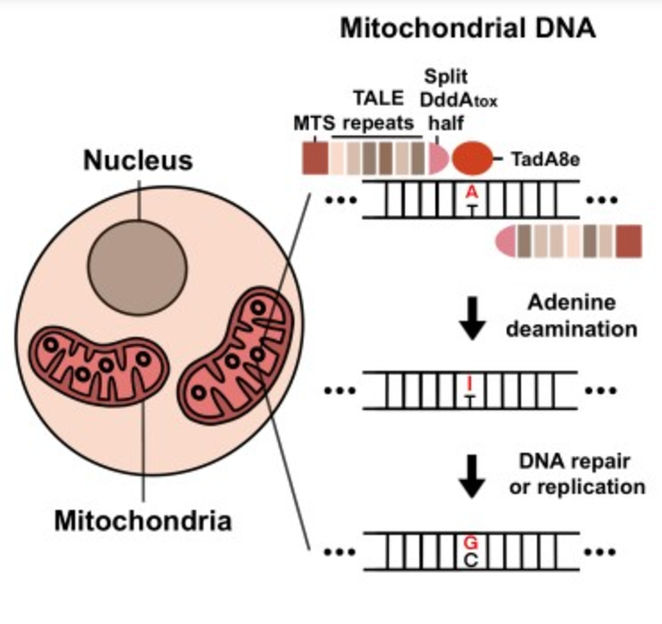
Resumen gráfico que muestra cómo funcionan los TALED en las mitocondrias. Primero, la adenina se desamina a inosina. A continuación, la inosina se convierte en guanina mediante la reparación o replicación del ADN.
Institute for Basic Science
Desde la identificación de la primera enzima de restricción en 1968, la invención de la reacción en cadena de la polimerasa (PCR) en 1985 y la demostración de la edición del genoma mediada por CRISPR en 2013, cada nuevo descubrimiento en biotecnología mejoró aún más nuestra capacidad de manipular el ADN, el plano de la vida. En particular, el reciente desarrollo del sistema CRISPR-Cas, o "tijeras genéticas", ha permitido la edición integral del genoma de las células vivas. Esto ha abierto nuevas posibilidades para tratar enfermedades genéticas antes incurables mediante la edición de las mutaciones de nuestro genoma.
Sin embargo, mientras que la edición de genes ha tenido mucho éxito en el genoma nuclear de las células, los científicos no han tenido éxito en la edición de las mitocondrias, que también tienen su propio genoma. Las mitocondrias, la llamada "central eléctrica de las células", son minúsculos orgánulos en las células que sirven como fábricas de generación de energía. Al ser un orgánulo importante para el metabolismo energético, si el gen está mutado, provoca graves enfermedades genéticas relacionadas con el metabolismo energético.
El director del Centro de Ingeniería Genómica, KIM Jin-Soo, explicó: "Hay algunas enfermedades hereditarias extremadamente desagradables que surgen debido a defectos en el ADN mitocondrial. Por ejemplo, la neuropatía óptica hereditaria de Leber (LHON), que provoca ceguera repentina en ambos ojos, está causada por una simple mutación puntual en el ADN mitocondrial". Otra enfermedad relacionada con el gen mitocondrial es la encefalomiopatía mitocondrial con acidosis láctica y episodios de apoplejía (MELAS), que destruye lentamente el cerebro del paciente. Algunos estudios sugieren incluso que las anomalías en el ADN mitocondrial pueden ser también responsables de enfermedades degenerativas como la enfermedad de Alzheimer y la distrofia muscular.
El genoma mitocondrial se hereda por línea materna. Se conocen 90 mutaciones puntuales causantes de enfermedades en el ADN mitocondrial, que en total afectan al menos a 1 de cada 5.000 individuos. Muchas de las herramientas de edición del genoma existentes no han podido utilizarse debido a las limitaciones del método de administración a las mitocondrias. Por ejemplo, la plataforma CRISPR-Cas no es aplicable para editar estas mutaciones en las mitocondrias, porque el ARN guía no puede entrar en el propio orgánulo.
"Otro problema es que hay una escasez de modelos animales de estas enfermedades mitocondriales. Esto se debe a que actualmente no es posible diseñar las mutaciones mitocondriales necesarias para crear modelos animales", añadió el director Kim. "La falta de modelos animales dificulta mucho el desarrollo y el ensayo de terapias para estas enfermedades".
Por ello, la tecnología fiable para editar el ADN mitocondrial es una de las últimas fronteras de la ingeniería genómica que debe explorarse para conquistar todas las enfermedades genéticas conocidas, y los científicos más selectos del mundo llevan años esforzándose por hacerla realidad.
En 2020, los investigadores dirigidos por David R. LIU, del Instituto Broad de Harvard y el MIT, crearon un nuevo editor de bases llamado DddA-derived cytosine base editors (DdCBEs) que puede realizar la conversión de C a T del ADN en las mitocondrias. Esto fue posible gracias a la creación de una nueva tecnología de edición de genes denominada edición de bases, que convierte una base de un nucleótido en otra sin romper el ADN. Sin embargo, esta técnica también tenía sus limitaciones. No sólo está restringida a la conversión de C a T, sino que se limita principalmente al motivo TC, lo que la convierte en un convertidor TC-TT. Esto significa que sólo puede corregir 9 de 90 (= 10%) mutaciones puntuales mitocondriales patógenas confirmadas. Durante mucho tiempo se pensó que la conversión de A a G del ADN mitocondrial era imposible.
El primer autor, CHO Sung-Ik, dijo: "Empezamos a pensar en formas de superar estas limitaciones. Como resultado, pudimos crear una novedosa plataforma de edición de genes llamada TALED que puede lograr la conversión de A a G. Nuestro nuevo editor de bases amplió drásticamente el alcance de la edición del genoma mitocondrial. Esto puede suponer una gran contribución no sólo para crear un modelo de enfermedad, sino también para desarrollar un tratamiento". Cabe destacar que la capacidad de realizar conversiones de A a G en el ADNmt humano permitiría corregir 39 (= 43%) de las 90 mutaciones patógenas conocidas.
Los investigadores crearon el TALED fusionando tres componentes diferentes. El primer componente es un efector de tipo activador de la transcripción (TALE), capaz de dirigirse a una secuencia de ADN. El segundo componente es TadA8e, una adenina desaminasa para facilitar la conversión de A a G. El tercer componente, DddAtox, es una citosina desaminasa que hace el ADN más accesible a TadA8e.
Un aspecto interesante del TALED es la capacidad de TadA8e para realizar la edición de A a G en las mitocondrias, que poseen ADN de doble cadena (dsDNA). Se trata de un fenómeno misterioso, ya que TadA8e es una proteína que se sabe que sólo es específica para el ADN de cadena simple. El director Kim dijo: "A nadie se le había ocurrido utilizar TadA8e para realizar la edición de bases en las mitocondrias, ya que se supone que sólo es específica del ADN monocatenario. Este enfoque de pensar fuera de la caja fue lo que realmente nos ayudó a inventar TALED".
Los investigadores teorizaron que el DddAtox permite que el dsDNA sea accesible al desenrollar transitoriamente la doble cadena. Esta ventana de tiempo, fugaz pero temporal, permite a TadA8e, una enzima de acción súper rápida, realizar rápidamente las ediciones necesarias. Además de modificar los componentes de TALED, los investigadores también desarrollaron una tecnología capaz de editar simultáneamente las bases A-G y C-T, así como de editar únicamente las bases A-G.
El grupo demostró esta nueva tecnología creando un clon derivado de una sola célula que contenía las ediciones de ADNmt deseadas. Además, se comprobó que los TALED no son citotóxicos ni causan inestabilidad en el ADNmt. Asimismo, no se produjeron ediciones no deseadas en el ADN nuclear y hubo muy pocos efectos no deseados en el ADNmt. Los investigadores se proponen ahora mejorar los TALED aumentando la eficacia y la especificidad de la edición, lo que permitiría corregir las mutaciones del ADNmt causantes de enfermedades en embriones, fetos, recién nacidos o pacientes adultos. El grupo también se está centrando en el desarrollo de TALEDs adecuados para la edición de bases de A a G en el ADN del cloroplasto, que codifica genes esenciales para la fotosíntesis en las plantas.
William I. Suh, comunicador científico del Instituto de Ciencias Básicas, aclamó: "Creo que la importancia de este descubrimiento es comparable a la invención del LED azul, que fue galardonado con el Premio Nobel en 2014. Al igual que el LED azul fue la pieza final del rompecabezas que nos permitió tener una fuente de luz LED blanca de alta eficiencia energética, se espera que TALED marque el comienzo de una nueva era de la ingeniería genómica."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.








































