Bloqueo de las células tumorales
Un nuevo inhibidor bloquea las células tumorales
Las proteínas fosfatasas son las contrapartes de las proteínas quinasas y, juntas, estos dos grupos de enzimas controlan prácticamente todos los aspectos del comportamiento celular. Por eso, poder modular la actividad de determinadas quinasas o fosfatasas es la base de una lista creciente de tratamientos médicos, desde amortiguar la inflamación en el trasplante de órganos hasta detener la proliferación de células leucémicas. Un nuevo inhibidor, descubierto en la Universidad de Konstanz, detiene una enzima crítica en el interior de las células tumorales, bloqueándolas. Este bloqueo celular impide que las células tumorales invadan los tejidos vecinos sanos, lo que podría allanar el camino hacia la supresión de la metástasis tumoral. Los resultados se publicaron en la edición en línea de "Cell Chemical Biology" el 19 de abril de 2022.
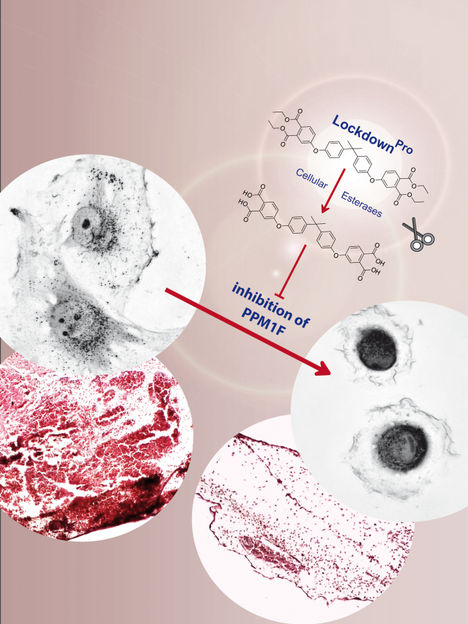
Mediante la inhibición selectiva de la proteína fosfatasa PPM1F, LockdownPro detiene la invasión de las células tumorales
Tanja Grimm und Marleen Herbinger, Universität Konstanz
Todos los procesos celulares de nuestro organismo, incluidos el crecimiento, la proliferación, la diferenciación y la migración, dependen de la interacción entre las proteínas quinasas y las proteínas fosfatasas, enzimas que regulan el estado de fosforilación y, por tanto, la función de las proteínas. Cuando la fosforilación de proteínas clave se descontrola, las células sufren graves consecuencias. No es de extrañar que la fosforilación desordenada de las proteínas sea uno de los rasgos distintivos de las células cancerosas.
Por ello, los inhibidores de moléculas pequeñas de estas enzimas, sobre todo los inhibidores de las cinasas, han revolucionado el tratamiento de los tumores. En principio, las fosfatasas también constituyen prometedoras dianas farmacológicas; sin embargo, este grupo de enzimas ha sido difícil de abordar mediante pequeñas moléculas. Ahora, un equipo de investigación dirigido por Christof Hauck, profesor de Biología Celular, ha identificado un inhibidor específico de la proteína fosfatasa PPM1F. Como esta enzima es un facilitador clave de la motilidad celular, las células tratadas con el inhibidor son incapaces de moverse, lo que hace que las células tumorales permanezcan atascadas en su lugar.
Hasta ahora, el desarrollo de inhibidores específicos de las proteínas fosfatasas ha sido un reto para los bioquímicos. Esto se debe, al menos en parte, al centro reactivo poco profundo y sin pretensiones de la mayoría de las proteínas fosfatasas, que no ofrece una interfaz de unión prominente para los inhibidores. Por lo tanto, la mejor oportunidad de bloquear la actividad de una fosfatasa específica proviene de los inhibidores, que influyen en la enzima a distancia, los llamados inhibidores alostéricos. Sin embargo, encontrar un agente de este tipo es difícil, como la búsqueda de la proverbial aguja en el pajar.
Empujar el azar aumentando los números
Para encontrar un compuesto con estas peculiares propiedades, Tanja Grimm, investigadora de doctorado del equipo del profesor Hauck y miembro de la Escuela de Investigación de Biología Química de Constanza, se asoció con el Centro de Cribado del Departamento de Biología. El objetivo era pasar de las laboriosas pruebas bioquímicas de la actividad enzimática a un procedimiento automatizado a microescala. Tanja Grimm y el Centro de Cribado fueron capaces de probar más de 55.000 compuestos, desarrollar un algoritmo quimioinformático para identificar las principales sustancias de éxito, reevaluar 200 candidatos varias veces y, posteriormente, acabar con un puñado de potenciales inhibidores de la PPM1F.
Aunque todas estas moléculas eran capaces de bloquear la enzima purificada, sólo un compuesto era selectivo para la PPM1F, mientras que el resto mostraba una actividad inhibidora no deseada para otras enzimas. Por desgracia, el inhibidor selectivo de la PPM1F también tenía un inconveniente: Tenía grupos polares, lo que hacía problemático el paso a través de la membrana de la célula, por lo que el inhibidor apenas podía alcanzar la enzima objetivo en el interior de la célula. Para solucionar este problema, Tanja Grimm se asoció con un colega del Departamento de Química para sintetizar una versión modificada del compuesto, que luego pudo aplicar a las células intactas.
Detener las células tumorales en el acto
Como la PPM1F suele estar sobreexpresada en los tumores malignos, el siguiente paso era probar la actividad del inhibidor de la PPM1F en células cancerosas humanas. Anteriormente, se había demostrado que la supresión del gen PPM1F (mediante la corrupción de la secuencia de ADN que codifica la proteína) conduce a la inmovilidad de las células. De hecho, la aplicación del inhibidor provocó un fenotipo similar: Las células tumorales se pegaban firmemente al sustrato y dejaban de moverse. A la luz de esta sorprendente propiedad, los investigadores rebautizaron su novedoso inhibidor como "Lockdown", ya que esencialmente bloqueaba la elevada motilidad de estas células tumorales.
A continuación, el equipo probó si Lockdown también impediría que las células tumorales migraran a través de las barreras tisulares, un proceso denominado invasión de células tumorales. La invasión de las células tumorales está relacionada con la capacidad de éstas para formar metástasis en lugares distantes del cuerpo, lo que constituye una de las características clave de las células malignas. Es importante destacar que la aplicación de Lockdown fue capaz de impedir que las células de glioblastoma humano, una forma altamente invasiva de células tumorales cerebrales, atravesaran las barreras tisulares y entraran en el tejido sano. Por consiguiente, sustancias como Lockdown podrían servir de punto de partida para el desarrollo de agentes bloqueadores de la metástasis.
Los sustratos de la PPM1F son fundamentales para la invasión de las células tumorales
La posibilidad de controlar la PPM1F mediante inhibición química abre ahora también una nueva vía para el estudio de esta interesante enzima. Al parecer, los sustratos de la PPM1F deben ser reguladores críticos de la motilidad y la invasión de las células tumorales. Los investigadores esperan ahora que su trabajo permita descifrar todos estos sustratos descendentes con el fin de identificar otras dianas para futuros bloqueadores de la metástasis. "Puede que aún sea un sueño lejano, pero poder detener la metástasis tumoral supondría un gran avance, especialmente en situaciones en las que el tumor primario puede ser extirpado quirúrgicamente, pero en las que la aparición de metástasis pende como una espada de Damocles sobre los pacientes", afirma Tanja Grimm, primera autora del estudio.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.