La abundancia de "puertas secretas" en las proteínas humanas podría remodelar el descubrimiento de fármacos
La identificación de las vulnerabilidades ocultas en la superficie de las proteínas "no tratables" podría transformar el tratamiento de las enfermedades
Anuncios
El número de posibles dianas terapéuticas en las superficies de las proteínas humanas es mucho mayor de lo que se pensaba, según las conclusiones de un nuevo estudio publicado en la revista Nature.
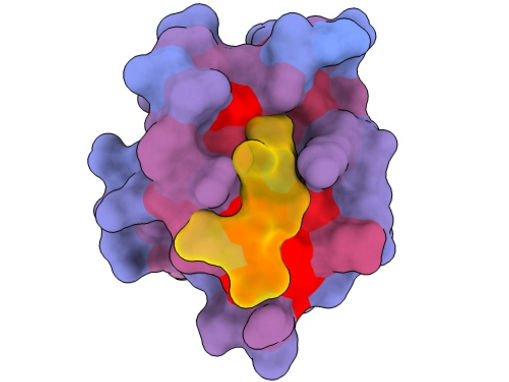
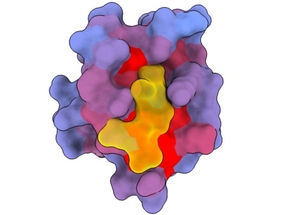
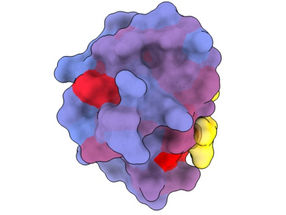
Imagen tridimensional que muestra la proteína humana PSD95-PDZ3 desde diferentes ángulos. Se muestra el compañero de unión CRIPT (amarillo) en el sitio activo con el gradiente de color de azul a rojo que indica un potencial creciente de efectos alostéricos. Basado en el acceso PDB 1BE9.
André Faure/CRG
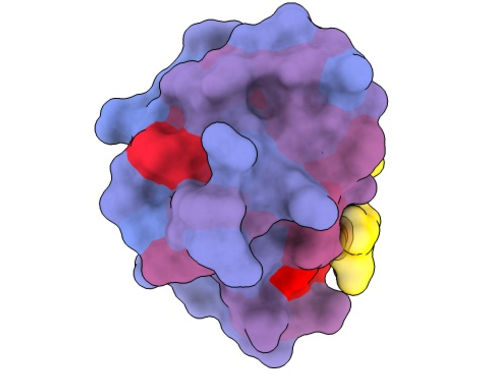
Imagen tridimensional que muestra la proteína humana PSD95-PDZ3 desde diferentes ángulos. Se muestra el compañero de unión CRIPT (amarillo) en el sitio activo con el gradiente de color de azul a rojo que indica un potencial creciente de efectos alostéricos. Basado en el acceso PDB 1BE9.
André Faure/CRG
Una técnica innovadora desarrollada por investigadores del Centro de Regulación Genómica (CRG) de Barcelona ha revelado la existencia de una multitud de puertas hasta ahora secretas que controlan la función de las proteínas y que, en teoría, podrían dirigirse a ellas para cambiar drásticamente el curso de afecciones tan variadas como la demencia, el cáncer o las enfermedades infecciosas.
El método, en el que se realizan decenas de miles de experimentos al mismo tiempo, ha servido para trazar el primer mapa de estas escurridizas dianas, también conocidas como sitios alostéricos, en dos de las proteínas humanas más comunes, revelando que son abundantes e identificables.
Este método podría cambiar las reglas del juego en el descubrimiento de fármacos y conducir a medicamentos más seguros, inteligentes y eficaces. Permite a los laboratorios de investigación de todo el mundo encontrar y explotar las vulnerabilidades de cualquier proteína, incluidas las que hasta ahora se consideraban "inofensivas".
"No sólo son abundantes estos sitios terapéuticos potenciales, sino que hay pruebas de que pueden manipularse de muchas maneras diferentes. En lugar de simplemente activarlos o desactivarlos, podríamos modular su actividad como un termostato. Desde el punto de vista de la ingeniería, eso es oro en paño, porque nos da mucho espacio para diseñar "fármacos inteligentes" que se dirijan a lo malo y dejen de lado lo bueno", explica André Faure, investigador postdoctoral del CRG y coprimer autor del artículo.
Las proteínas desempeñan un papel fundamental en todos los organismos vivos y desempeñan funciones vitales como proporcionar estructura, acelerar reacciones, actuar como mensajeros o combatir enfermedades. Están formadas por aminoácidos que se pliegan en innumerables formas diferentes en el espacio tridimensional. La forma de una proteína es crucial para su función, ya que un solo error en una secuencia de aminoácidos puede tener consecuencias devastadoras para la salud humana.
El alosterismo es uno de los grandes misterios sin resolver de la función de las proteínas. Los efectos alostéricos se producen cuando una molécula se une a la superficie de una proteína, lo que a su vez provoca cambios en un lugar distante de la misma, regulando su función por control remoto. Muchas de las mutaciones que causan enfermedades, entre las que se encuentran numerosas causas de cáncer, son patológicas debido a sus efectos alostéricos.
A pesar de su importancia fundamental, los sitios alostéricos son increíblemente difíciles de encontrar. Esto se debe a que las reglas que rigen el funcionamiento de las proteínas a nivel atómico están ocultas a la vista. Por ejemplo, una proteína puede cambiar de forma en presencia de una molécula entrante, revelando bolsillos ocultos en lo más profundo de su superficie que son potencialmente alostéricos pero que no son identificables utilizando únicamente la determinación de la estructura convencional.
Los buscadores de fármacos han diseñado tradicionalmente tratamientos dirigidos al sitio activo de una proteína, la pequeña región donde se producen las reacciones químicas o se unen las dianas. El inconveniente de estos fármacos, también conocidos como fármacos ortostéricos, es que los sitios activos de muchas proteínas son muy similares, por lo que los fármacos tienden a unirse e inhibir muchas proteínas diferentes a la vez, lo que provoca posibles efectos secundarios. En comparación, la especificidad de los sitios alostéricos significa que los fármacos alostéricos son algunos de los tipos de medicación más eficaces actualmente disponibles. Muchos fármacos alostéricos, que tratan diversas afecciones que van desde el cáncer al sida o los trastornos hormonales, se han descubierto por accidente.
Los autores del estudio abordaron este reto desarrollando una técnica denominada doble PCA profundo (ddPCA), que describen como un "experimento de fuerza bruta". "Rompemos las cosas a propósito de miles de maneras diferentes para construir una imagen completa de cómo funciona algo", explica el profesor de investigación ICREA Ben Lehner, coordinador del programa de Biología de Sistemas en el CRG y autor del estudio. "Es como sospechar de una bujía defectuosa, pero en lugar de comprobar sólo eso, el mecánico desmonta todo el coche y lo comprueba pieza por pieza. Probando diez mil cosas de una sola vez identificamos todas las piezas que realmente importan".
El método funciona cambiando los aminoácidos que componen una proteína, lo que da lugar a miles de versiones diferentes de la misma con sólo una o dos diferencias en la secuencia. Los efectos de las mutaciones se comprueban entonces todos al mismo tiempo en células vivas en el laboratorio.
"Cada célula es una pequeña fábrica que fabrica una versión diferente de la proteína. En un solo tubo de ensayo tenemos millones de fábricas diferentes, por lo que podemos comprobar muy rápidamente el funcionamiento de todas las versiones diferentes de una proteína", añade el Dr. Lehner. Los datos recogidos en los experimentos se introducen en redes neuronales, algoritmos que analizan los datos imitando el funcionamiento del cerebro humano, lo que da lugar a mapas exhaustivos que señalan la ubicación de los sitios alostéricos en las superficies de las proteínas.
Una de las grandes ventajas del método es que se trata de una técnica asequible y accesible a cualquier laboratorio de investigación del mundo. "Simplifica enormemente el proceso necesario para encontrar sitios alostéricos, y la técnica funciona con un nivel de precisión mejor que el de varios métodos de laboratorio más caros y que consumen más tiempo", afirma Júlia Domingo, coprimera autora del estudio. "Nuestra esperanza es que otros científicos utilicen la técnica para mapear de forma rápida y exhaustiva los sitios alostéricos de las proteínas humanas uno por uno".
Uno de los beneficios a largo plazo de la técnica es su potencial para estudiar la función y la evolución de las proteínas. Los autores del estudio creen que, si se amplía, el método podría dar lugar algún día a avances que permitan predecir con precisión las propiedades de las proteínas a partir de sus secuencias de aminoácidos. Si tiene éxito, los autores sostienen que esto marcaría el comienzo de una nueva era de la biología molecular predictiva, que permitiría un desarrollo mucho más rápido de nuevos medicamentos y de una industria limpia basada en la biología.
"Mientras que algunas herramientas pueden predecir la estructura de una proteína leyendo su secuencia, nuestro método va un paso más allá al decirnos cómo funciona una proteína. Esto forma parte de una visión más amplia para hacer que la biología sea tan manejable como los aviones, los puentes o los ordenadores. Llevamos más de 70 años enfrentándonos a los mismos retos, pero resulta que son más manejables de lo que creíamos. Si lo conseguimos, se abrirá un nuevo campo con posibilidades sin precedentes", concluye el Dr. Lehner.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.