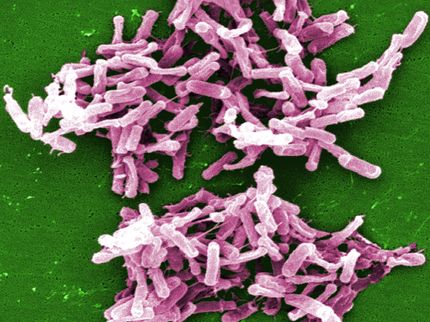
Se revela la armadura protectora de la superbacteria C.difficile
La espectacular estructura de la cota de malla podría explicar el éxito de C.diff a la hora de defenderse de los antibióticos y las moléculas del sistema inmunitario
La espectacular estructura de la armadura protectora de la superbacteria C.difficile ha sido revelada mostrando por primera vez la capa exterior, muy unida pero flexible, como una cota de malla.
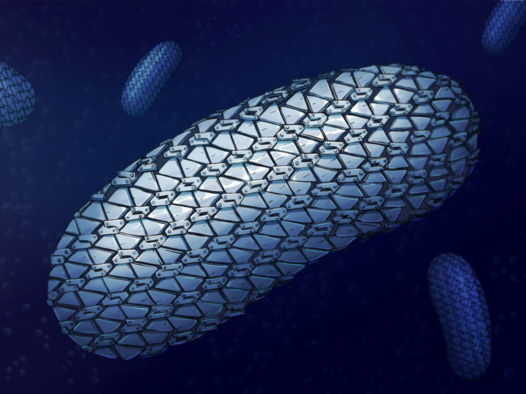
Se ha revelado por primera vez la espectacular estructura de la armadura protectora de la superbacteria C.difficile, que muestra la capa exterior, muy unida pero flexible, como una cota de malla. Según los científicos de las universidades de Newcastle, Sheffield y Glasgow que la han descubierto, este conjunto impide la entrada de moléculas y constituye un nuevo objetivo para futuros tratamientos.
Newcastle University, UK
Este conjunto impide la entrada de moléculas y constituye un nuevo objetivo para futuros tratamientos, según los científicos que lo han descubierto.
El equipo de científicos de las universidades de Newcastle, Sheffield y Glasgow, junto con sus colegas del Imperial College y el Diamond Light Source, han publicado en Nature Communications la estructura de la proteína principal, SlpA, que forma los eslabones de la cota de malla y cómo se organizan para formar un patrón y crear esta armadura flexible. Esto abre la posibilidad de diseñar fármacos específicos para C. diff que rompan la capa protectora y creen agujeros para permitir que las moléculas entren y maten a la célula.
Coraza protectora
Una de las muchas formas que tiene la superbacteria Clostridioides difficile, causante de la diarrea, para protegerse de los antibióticos es una capa especial que cubre la célula de toda la bacteria: la capa superficial o capa S. Esta armadura flexible protege contra la entrada de fármacos o moléculas liberadas por nuestro sistema inmunitario para combatir las bacterias.
El equipo determinó la estructura de las proteínas y su disposición mediante una combinación de rayos X y cristalografía electrónica.
La autora correspondiente, la Dra. Paula Salgado, profesora titular de Cristalografía Macromolecular en , que dirigió la investigación en la Universidad de Newcastle, dijo: "Empecé a trabajar en esta estructura hace más de 10 años, ha sido un viaje largo y duro, pero hemos obtenido unos resultados realmente emocionantes. Sorprendentemente, descubrimos que la proteína que forma la capa externa, SlpA, se empaqueta de forma muy compacta, con aberturas muy estrechas que permiten la entrada de muy pocas moléculas en las células. La capa S de otras bacterias estudiadas hasta ahora tiende a tener huecos más amplios, lo que permite que penetren moléculas más grandes. Esto puede explicar el éxito de C. diff a la hora de defenderse de los antibióticos y las moléculas del sistema inmunitario enviadas para atacarla.
"Lo más emocionante es que también abre la posibilidad de desarrollar fármacos que se dirijan a las interacciones que conforman la cadena de correo. Si las rompemos, podemos crear agujeros que permitan que los fármacos y las moléculas del sistema inmunitario entren en la célula y la maten".
Uno de los retos actuales en nuestra lucha contra las infecciones es la creciente capacidad de las bacterias para resistir a los antibióticos que utilizamos para tratar de matarlas. La resistencia a los antibióticos o, más generalmente, a los antimicrobianos (AMR), fue declarada por la OMS como una de las 10 principales amenazas mundiales para la salud pública a las que se enfrenta la humanidad.
Diferentes bacterias tienen diferentes mecanismos para resistir a los antibióticos y algunas tienen múltiples formas de evitar su acción: las llamadas superbacterias. Entre estas superbacterias se encuentra la C. diff, una bacteria que infecta el intestino humano y es resistente a todos los fármacos actuales, excepto a tres. No sólo eso, sino que se convierte en un problema cuando tomamos antibióticos, ya que las bacterias buenas del intestino mueren junto a las que causan una infección y, como la C. diff es resistente, puede crecer y causar enfermedades que van desde la diarrea hasta la muerte por lesiones masivas en el intestino. Otro problema es el hecho de que la única forma de tratar el C . diff es tomar antibióticos, por lo que se reinicia el ciclo y muchas personas contraen infecciones recurrentes.
Determinar la estructura permite la posibilidad de diseñar fármacos específicos para C. diff que rompan la capa S, la cota de malla, y creen agujeros que permitan a las moléculas entrar y matar a la célula.
El Dr. Rob Fagan y el profesor Per Bullough, de la Universidad de Sheffield, realizaron el trabajo de cristalografía electrónica.
El Dr. Fagan dijo: "Ahora estamos estudiando cómo podrían utilizarse nuestros hallazgos para encontrar nuevas formas de tratar las infecciones por C . diff, como el uso de bacteriófagos para adherirse a las células de C. diff y matarlas, una posible y prometedora alternativa a los fármacos antibióticos tradicionales".
En el equipo del Dr. Salgado en la Universidad de Newcastle, la estudiante de doctorado Paola Lanzoni-Mangutchi y la Dra. Anna Barwinska-Sendra desentrañaron los detalles estructurales y funcionales de los bloques de construcción y determinaron la estructura cristalina general de SlpA por rayos X. Paola dijo: "Este ha sido un proyecto desafiante y hemos pasado muchas horas juntas, cultivando el difícilbicho y recogiendo datos de rayos X en el sincrotrón Diamond Light Source".
La Dra. Barwinska-Sendra añadió: "Trabajar juntas ha sido la clave de nuestro éxito, es muy emocionante formar parte de este equipo y poder finalmente compartir nuestro trabajo."
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.