Una esponja jugando en defensa
Las bacterias son extremadamente ingeniosas a la hora de adaptarse a un entorno determinado: Un equipo de investigadores ha descubierto un nuevo truco
Cada año, al menos 1,27 millones de personas mueren por una infección con bacterias resistentes a los antibióticos estándar, según revela un estudio publicado recientemente en la revista The Lancet. Los autores temen que esta cifra pueda aumentar hasta diez millones de personas en 2050.
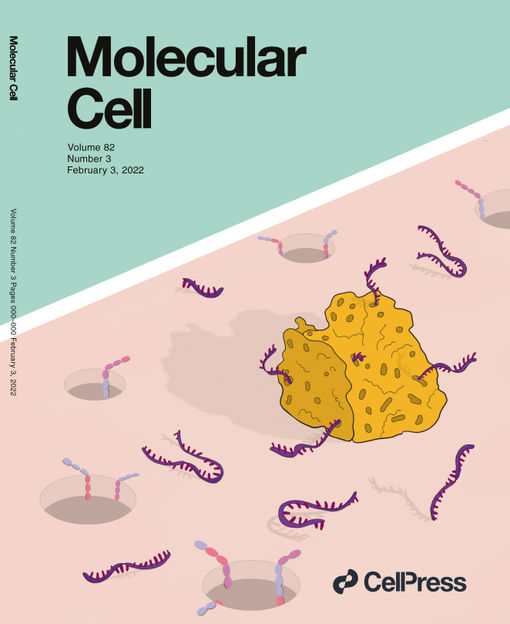
Ilustración artística de una esponja de ARN en acción en la portada de Molecular Cell.
Imma Matera (Tipstudio)
Esto hace que la búsqueda de nuevas sustancias eficaces contra las cepas bacterianas resistentes sea más urgente que nunca. Un posible enfoque se centra en los antibióticos basados en el ARN programable. Sin embargo, esto requiere un conocimiento profundo de las vías y mecanismos de señalización basados en el ARN durante una infección.
Nuevas vías de señalización identificadas
Este es el tema de la investigación en el Instituto de Biología Molecular de la Infección (IMIB) de la Universidad de Würzburg y en el Instituto Helmholtz para la Investigación de la Infección basada en el ARN. Los investigadores del laboratorio del profesor Jörg Vogel, titular de la cátedra de Biología Molecular de la Infección I en la JMU y director del HIRI, han descubierto nuevos detalles de estas vías y mecanismos de señalización. Presentan los resultados de su estudio en el último número de la revista Molecular Cell.
Gianluca Matera, estudiante de doctorado en el IMIB, ofrece más información sobre los antecedentes del trabajo del que es coautor junto con Jörg Vogel, diciendo "Muchas bacterias, como la Escherichia coli y la Salmonella enterica, tienen una envoltura celular que consta de una membrana externa y otra interna. La función principal de esta envoltura es proteger a las bacterias de su entorno, pero también tiene que ser permeable a los nutrientes que las bacterias necesitan para desarrollarse".
Un actor desconocido hasta ahora
Numerosas entidades de ARN interactúan para gestionar qué sustancias pueden atravesar la envoltura celular y cuáles quedan bloqueadas en un momento dado, lo que permite a las bacterias protegerse contra los antibióticos, por ejemplo. Los investigadores han identificado ahora un protagonista hasta ahora desconocido en la bacteria Salmonella enterica: una "esponja de ARN".
Estas esponjas pertenecen a la clase de los "ARN pequeños". El estudio de Würzburg muestra que la esponja de ARN OppX imita el objetivo real de unión de un ARNs especial, el llamado ARNs MicF, en la membrana externa bacteriana, interceptándolo antes de que llegue a su destino. En otras palabras, lo absorbe como una esponja.
Comunicación de las membranas
El ARNs MicF desempeña un papel crucial en los procesos de la envoltura bacteriana. "Las membranas externa e interna de la envoltura bacteriana no pueden funcionar de forma independiente la una de la otra. Por tanto, tiene que haber mecanismos que les permitan comunicarse entre sí. Los pequeños ARN no codificantes, como MicF, son una clase de estos reguladores", explica Gianluca Matera. Utilizando una nueva técnica desarrollada en la Universidad Hebrea de Jerusalén, el joven científico ha identificado ahora las parejas de interacción de todos estos ARNs en Salmonella, de forma exhaustiva y en un solo paso.
Los investigadores son capaces de describir con detalle el efecto de este proceso de interceptación: "Normalmente, OppX aumenta la permeabilidad de la membrana al potenciar la expresión de uno de los principales poros de la membrana externa bacteriana", especifica Matera. El nombre científico de este poro es OmpF.
Si la bacteria carece de la esponja OppX, su crecimiento se verá restringido, especialmente en un entorno pobre en nutrientes. Sin embargo, si se dispone de cantidades suficientes de OppX, los poros OmpF de la membrana también se vuelven más activos, aumentando la captación de nutrientes si éstos son escasos.
Impacto indirecto en los antibióticos
Los poros OmpF también asumen una función clave cuando las bacterias son atacadas por antibióticos: Las sustancias los utilizan como sus principales puntos de entrada en la célula. "Indirectamente, OppX podría tener un impacto en la eficacia de los antibióticos al impulsar la producción de OmpF y, por tanto, la captación del propio antibiótico", afirma Matera.
OppX es el primer regulador conocido de la actividad de MicF; los datos recientemente publicados incluso apoyan la suposición de que OppX es la esponja más importante, si no la única, para el ARNs de MicF. Por lo tanto, conocerlo es crucial para comprender plenamente la actividad celular de MicF, según los autores del estudio.
Estos nuevos hallazgos se basan en estudios de bacterias cultivadas in vitro en condiciones de laboratorio. Los científicos creen que el próximo reto será ampliar estos estudios a condiciones más "realistas". El primer paso en esta dirección ya se ha dado: "Actualmente estamos descodificando el interactoma del ARN de la Salmonella en células huésped infectadas", explica Jörg Vogel. "La resistencia a los antibióticos es una de las principales amenazas sanitarias de nuestro tiempo; por eso nuestra investigación básica se esfuerza por contribuir al desarrollo de nuevas terapias".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.