Se dilucida la estructura del interruptor central de la inflamación
El estudio podría proporcionar a la medicina una poderosa herramienta terapéutica
Investigadores de las universidades de Bonn y Ratisbona han dilucidado la estructura de un interruptor inflamatorio celular central. Su trabajo muestra a qué sitio de la gigantesca proteína llamada NLRP3 pueden unirse los inhibidores. Esto abre el camino para desarrollar nuevos fármacos que podrían dirigirse a enfermedades inflamatorias como la gota, la diabetes de tipo 2 o incluso la enfermedad de Alzheimer. Los resultados se publican en la revista Nature.
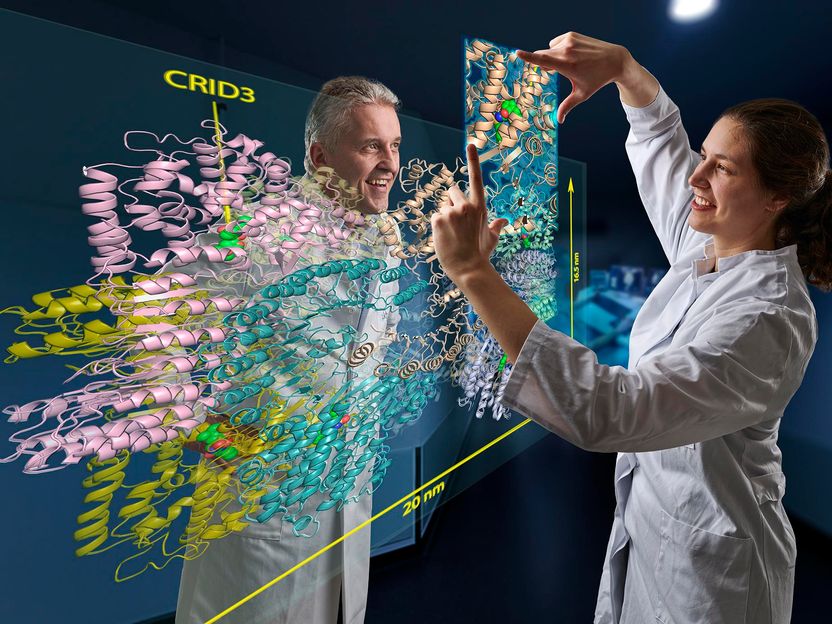
La estudiante de doctorado Inga Hochheiser y el Prof. Dr. Matthias Geyer observando el sitio de unión de CRID3 en la proteína NLRP3.
Johann F. Saba/UKB
En su estudio, los investigadores investigaron una molécula proteica con la críptica abreviatura NLRP3. Se trata de una especie de sensor de peligro en la célula: Hace sonar la alarma cuando la célula está sometida a estrés, por ejemplo, por una infección bacteriana o por toxinas.
El NLRP3 induce entonces la formación de poros en la membrana celular, lo que finalmente provoca la muerte de la célula. Sin embargo, antes de eso, la molécula sensora estimula la formación de sustancias mensajeras inflamatorias que se liberan a través de la membrana perforada. Estas llamadas citoquinas reclutan más células inmunitarias en el lugar y garantizan que las células de la zona circundante se suiciden, impidiendo así que la bacteria o el virus sigan propagándose.
"El resultado es una respuesta inflamatoria masiva", explica el director del estudio, el profesor Dr. Matthias Geyer, del Instituto de Biología Estructural de la Universidad de Bonn. "Esto es ciertamente muy útil para la defensa contra los patógenos. Pero si esta respuesta se sobredimensiona o se desencadena incluso por señales inofensivas, puede dar lugar a enfermedades inflamatorias crónicas, como la diabetes de tipo II, la gota, la enfermedad de Crohn o incluso demencias como el Alzheimer".
Contención selectiva de la inflamación
Por ello, los investigadores de todo el mundo buscan formas de atacar los procesos inflamatorios sin alterar todo el mecanismo de la respuesta inmunitaria. Hace ya 20 años, la empresa farmacéutica estadounidense Pfizer publicó un interesante hallazgo en este sentido: Ciertas sustancias activas impiden la liberación de citoquinas, los mensajeros inflamatorios más importantes. Sin embargo, hasta ahora se desconocía cómo lo hacen estos CRID (fármacos inhibidores de la liberación de citoquinas).
Desde hace varios años se sabe que los CRID impiden de algún modo que los sensores de peligro celulares den la voz de alarma. "Ahora hemos descubierto la forma en que ejercen este efecto", explica Inga Hochheiser, colega de Geyer. Para ello, se aislaron grandes cantidades de NLRP3 de las células, se purificaron y se añadió el inhibidor CRID3. Hochheiser dejó caer porciones diminutas de esta mezcla en un soporte y luego las congeló rápidamente.
Este método crea una fina película de hielo que contiene millones de moléculas de NLRP3 a las que se une el CRID3. Éstas pueden observarse con un microscopio electrónico. Dado que las moléculas caen de forma diferente al caer, se pueden ver diferentes lados de ellas bajo el microscopio. "Estas vistas pueden combinarse para crear una imagen tridimensional", explica Hochheiser.
Las imágenes de crio-EM permiten una visión detallada de la estructura del sensor de peligro inactivado por CRID3. Revelan que el NLRP3 en su forma inactiva se ensambla en una megamolécula. Está formada por diez unidades de NLRP3 que juntas forman una especie de jaula. "El resultado más emocionante de nuestro trabajo, sin embargo, es que hemos podido identificar la molécula de CRID3 acoplada en su sitio de unión", se complace en informar Geyer. "Ese era un hueso duro de roer que muchos grupos de todo el mundo han intentado descifrar".
El inhibidor impide la activación de la molécula gigante
Los sitios de unión (los biólogos estructurales también hablan de "bolsillos") se encuentran dentro de la jaula. Cada una de las diez unidades de NLRP3 tiene uno de estos bolsillos. Cuando está ocupado por el CRID3, el inhibidor bloquea un mecanismo de solapa necesario para la activación del NLRP3. Al igual que una rosa en flor, que sólo puede ser visitada por una abeja en este estado, ciertas partes de la proteína NLRP3 llegan a la superficie de la jaula cuando la solapa se gira y, por tanto, se vuelven accesibles.
La NLRP3 es un representante de toda una familia de proteínas similares. Se supone que cada una de ellas desempeña su tarea específica en diferentes procesos inflamatorios. "Basándonos en nuestra investigación, creemos que las bolsas de todas estas NLRP son diferentes", afirma Geyer. "Por tanto, es probable que se pueda encontrar un inhibidor específico para cada uno de ellos". Esto proporciona a los investigadores todo un arsenal de nuevas armas potenciales contra diversas enfermedades inflamatorias.
Por ejemplo, el trabajo actual permite buscar alternativas más eficaces al CRID3 que además tengan menos efectos secundarios. Pero esto es sólo el principio, afirma Geyer, que también es miembro del Grupo de Excelencia de Inmunosensación2 de la Universidad de Bonn. "Estoy convencido de que nuestro estudio abre un nuevo y fructífero campo de investigación que mantendrá ocupados a los investigadores durante décadas".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.







































