El pangenoma, clave para las nuevas terapias
La diversidad genética abre nuevas vías para tratar enfermedades mortales
El Aspergillus fumigatus es un hongo muy extendido en el medio ambiente y que provoca infecciones mortales en los seres humanos. Un equipo internacional de investigadores ha analizado ahora la gran diversidad genética de este patógeno.
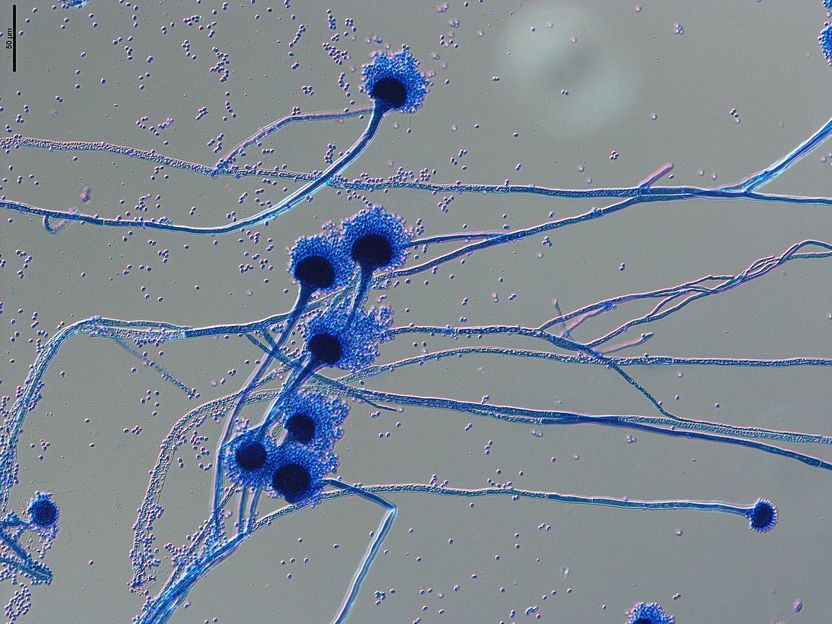
Imagen microscópica de portadores de esporas del hongo patógeno humano Aspergillus fumigatus. Las esporas, conocidas como conidios, con un diámetro de 1 a 2 micrómetros, se propagan por el aire y entran fácilmente en nuestras vías respiratorias, donde pueden causar infecciones graves en individuos inmunodeprimidos.
Grit Walther/Leibniz-HKI
Infecciones fúngicas graves
El hongo Aspergillus fumigatus provoca cada año infecciones graves en más de 300.000 personas en todo el mundo. Estas infecciones son especialmente problemáticas en pacientes inmunodeprimidos, con una tasa de mortalidad de hasta el 50%. El tratamiento de estas enfermedades se basa en los antimicóticos triazólicos. Sin embargo, la resistencia a estos fármacos está aumentando. Además, la tasa de mortalidad de estas infecciones resistentes a los fármacos es hasta un 25% mayor. Por otra parte, en cerca del 30% de las infecciones resistentes se desconoce el mecanismo de resistencia. En consecuencia, es aún más complicado identificar y tratar adecuadamente estas infecciones.
"A pesar de este elevado número de infecciones al año, se carece de un estudio exhaustivo de la diversidad genómica tanto en muestras clínicas como ambientales. En particular, queríamos dilucidar la importancia de esta diversidad genética en la infección y el desarrollo de la resistencia a los antimicóticos", explica Gianni Panagiotou, jefe del grupo de investigación de Biología de Sistemas y Bioinformática del Instituto Leibniz de Investigación de Productos Naturales y Biología de las Infecciones - Instituto Hans Knöll - de Jena (Leibniz-HKI). Los investigadores están seguros de que la diversidad genética intraespecífica del patógeno también desempeña un papel importante en la infección.
El pangenoma - diversidad genética explorada
En su estudio, el equipo de investigadores de Jena, Würzburg y Hong Kong, secuenció y analizó un gran número de genomas de este extendido moho, incluyendo cepas del medio ambiente así como muestras clínicas. Esta gran cantidad de información genómica reveló que los miembros de la especie difieren considerablemente en su contenido genético. Los autores utilizaron esta información genética para definir el conjunto de genes de la especie, el llamado pangenoma, que abarca el rango genético de Aspergillus fumigatus. Esto demostró que dos tercios de la información genética están compuestos por los llamados genes centrales que se dan en todos los aislados. El tercio restante, sin embargo, contiene genes accesorios que no se encuentran en todos los aislamientos y que, por tanto, son prescindibles para el crecimiento del hongo, pero que pueden desempeñar funciones aún no descubiertas para el hongo en el medio ambiente y en la infección humana.
Una línea genética específica causa la mayoría de las infecciones
Al comparar los genomas de los hongos del medio ambiente y de las muestras de los pacientes, un grupo genético concreto dentro de la especie Aspergillus fumigatus tenía más probabilidades de causar infecciones en los seres humanos. Los genomas de este grupo tenían características especiales. Por ejemplo, codificaban más transportadores transmembrana, proteínas de unión al hierro y enzimas del metabolismo básico. Estas características genéticas son interesantes como objetivos potenciales para nuevos fármacos, ya que podrían desempeñar un papel en la supervivencia del hongo en el pulmón humano.
Además, los investigadores identificaron pequeñas diferencias genéticas entre los aislados en un "estudio de asociación de todo el genoma". Ciertas desviaciones en la secuencia de ADN se produjeron con mayor frecuencia en los aislamientos clínicos que en los ambientales. Con este método, el equipo identificó genes vinculados a la resistencia a los triazoles en formas aún desconocidas. "Aquí también vemos objetivos prometedores para futuras opciones terapéuticas. Por tanto, nuestra atención se centra en seguir estudiando aquellos genes y proteínas que están asociados a estos mecanismos de resistencia no descubiertos hasta ahora", afirma Amelia E. Barber, primera autora del estudio y directora del grupo de investigación junior Fungal Informatics en el Leibniz-HKI.
Esperanza de nuevas terapias
Los autores presentan los resultados de sus análisis bioinformáticos en el último número de la revista Nature Microbiology. Su visión global del "conjunto de herramientas" genéticas de Aspergillus fumigatus señala el camino hacia posibles nuevos enfoques terapéuticos. Su definición de los genes y las vías de señalización que están presentes en todos los miembros de la especie puede considerarse como buenas dianas terapéuticas. Un gen o un proceso metabólico que sólo esté presente en el 90% de los hongos causantes de enfermedades no sería deseable como diana terapéutica, ya que el 10% de los patógenos no se verían afectados.
El estudio también nos hace ver que con la diversidad genética dentro de una especie, siempre estamos viendo sólo una instantánea de los procesos evolutivos en curso. La composición genética del hongo estudiado está sujeta a un alto grado de dinamismo debido a la intensa interacción con su entorno y puede conducir a una división en (sub)especies más especializadas durante largos periodos de tiempo.
Para su trabajo, los investigadores pudieron contar con la cooperación de grandes redes de investigación. El acceso a los aislados clínicos fue posible gracias al Centro Nacional de Referencia para Infecciones Fúngicas Invasivas, con sede en el Leibniz-HKI, que cuenta con el apoyo del Instituto Robert Koch y fondos del Ministerio Federal de Sanidad. El consorcio InfectControl, financiado por el BMBF, proporcionó el marco para el trabajo sobre la resistencia a los triazoles y su propagación en el medio ambiente y en los aislados clínicos. El Cluster of Excellence Balance of the Microverse, financiado por la Fundación Alemana de Investigación, permitió establecer el grupo de investigación junior Fungal Informatics y apoyó el análisis bioinformático de los enormes conjuntos de datos.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.