OSCAR detecta las células en modo de espera
Nueva herramienta para comprender mejor la biología de las células madre latentes
Anuncios
La latencia es un estado similar al sueño de las células que las protege del daño genético y prolonga así su supervivencia. Este estado es reversible y se caracteriza por una baja actividad metabólica y tasa de división. Investigadores del Instituto Leibniz sobre el Envejecimiento - Instituto Fritz Lipmann (FLI) y de la Universidad de Oxford (Reino Unido) han desarrollado un método para detectar la latencia en tiempo real. Utilizando la medida de fluorescencia OSCAR (Optical Stem Cell Activity Reporter), se pudieron identificar y aislar poblaciones celulares con diferentes valores de latencia en el modelo de intestino delgado. OSCAR es, por tanto, una herramienta adecuada para comprender mejor la biología de las células madre latentes.
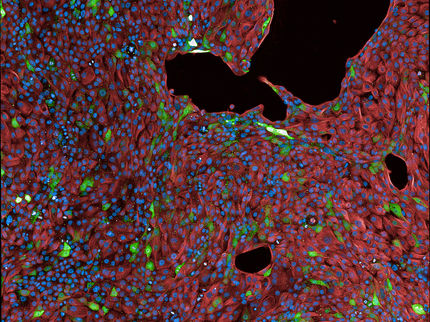
OSCAR (reportero óptico de la actividad de las células madre) puede utilizarse para detectar células madre latentes en los tejidos. Se incorpora un péptido corto a la columna vertebral de una proteína fluorescente. Debido a la falta de fosforilación, se observa un aumento de la fluorescencia verde.
FLI / Kerstin Wagner & Francesco Neri, created with BioRender.com
Un ejemplo importante de células latentes son las células madre somáticas, que se caracterizan por su potencial de diferenciación y autorrenovación. Tienen un alto potencial de trasplante, son más resistentes al estrés celular y tienen un gran potencial para ser utilizadas en la medicina regenerativa. Las células madre hematopoyéticas de la médula ósea, por ejemplo, sólo son necesarias cuando se lesionan y, por lo demás, existen en estado latente. Del mismo modo, en el cáncer, la recaída después de una terapia aparentemente exitosa, se cree que es causada por la activación de las células madre cancerosas latentes a largo plazo.
Este estado de reposo celular se denomina latencia. Es reversible y se caracteriza por la reducción de la actividad metabólica, la división celular y la síntesis de ARNm. Este estado de reposo (modo de espera) protege así a la célula del daño genético, prolonga su supervivencia y es fundamental para la homeostasis de los tejidos y la respuesta celular a las lesiones o los trasplantes. Las células latentes se encuentran en numerosos tejidos y órganos. Sin embargo, su identificación, aislamiento y caracterización, independientemente del tejido de origen, es difícil. Investigadores del Instituto Leibniz sobre el Envejecimiento - Instituto Fritz Lipmann (FLI) de Jena (Alemania), en colaboración con socios de la Universidad de Oxford (Reino Unido), han desarrollado ahora un método de medición por fluorescencia para detectar y aislar las células latentes en tipos celulares específicos en tiempo real.
Dificultades en la detección de células en reposo
"Las células madre somáticas suelen identificarse mediante marcadores de superficie, proteínas fluorescentes o a través de células etiquetadas. Sin embargo, estos métodos sólo etiquetan líneas de células madre específicas, sólo son válidos para un determinado tipo de especies y suponen un gran reto técnico", explica el Dr. Rasmus Freter, del FLI, primer autor del estudio publicado recientemente en Nature Communications. "Todavía no se ha encontrado un marcador fiable, específico y, sobre todo, conservado para las células madre quiescentes que permita su visualización y aislamiento". Además, el aislamiento de estas células mediante marcadores de superficie requiere conocimientos previos, lo que impide la caracterización de poblaciones de células madre previamente desconocidas desde el principio. Por ello, los investigadores de Jena buscaron un método para detectar más fácilmente las células latentes.
La baja fosforilación de RNApII-Ser2 es característica de las células madre latentes
"Se sabe desde hace más de 10 años que las células madre latentes tienen una menor cantidad de ARN total", explica el Dr. Francesco Neri, jefe del grupo de investigación del FLI y ahora profesor asociado de la Universidad de Turín. El ARNm es transcrito por la ARN polimerasa II (ARNpII), que se fosforila para iniciar la transcripción del ARNm. Se detecta un alto nivel de fosforilación de la RNApII en las células activas proliferantes y diferenciadas, mientras que la baja fosforilación de la RNApII-Ser2 es altamente específica de las células quiescentes y las distingue de otros tipos de células. "Examinamos varios tejidos en busca de células madre adultas que tuvieran niveles bajos de fosforilación de RNApII-Ser2", informa el profesor Neri, "y así pudimos detectar células sin fosforilación detectable de RNApII-Ser2 en todos los tejidos examinados, incluidos el cerebro, las células madre hematopoyéticas y el intestino delgado".
Desarrollo de un reportero de quinasa fluorescente - OSCAR
"En un paso más, explotamos esta observación y buscamos específicamente un reportero fluorescente que pudiera distinguir entre células con alta o baja actividad quinasa RNApII-pSer2, con el fin de poder desarrollar una herramienta para identificar y aislar células vivas en reposo de cualquier tejido", dijo el Dr. Rasmus Freter, explicando los siguientes pasos.
Los investigadores lo lograron con un reportero óptico ratiométrico de la actividad de las células madre, llamado OSCAR, basado en el hecho de que la fosforilación de RNApII está en gran medida ausente en las células madre quiescentes de diferentes linajes. "La visualización adecuada de la actividad de las quinasas en las células vivas ha sido durante mucho tiempo un reto importante", señala el Dr. Freter. "Por ejemplo, la mayoría de los informadores de quinasas utilizan la tecnología FRET, pero ésta es técnicamente difícil y muy susceptible a las señales de fondo. Además, los rangos dinámicos de la relación señal/ruido son de un 20-30%, lo que es demasiado bajo para aislar las células mediante la clasificación celular activada por fluorescencia, FACS".
Para superar estas barreras técnicas y desarrollar una herramienta sensible y a la vez práctica, los investigadores del profesor Neri diseñaron un reportero de quinasa codificado genéticamente de la quinasa RNApII Ser2 relevante. Incorporaron un péptido corto que contenía un sitio aceptor de fosforilación específico en la columna vertebral de una proteína fluorescente. "En este contexto, la inserción del péptido sin fosforilar no afectó al rendimiento de la fluorescencia, mientras que la fosforilación del péptido insertado redujo la fluorescencia. En consecuencia, una fluorescencia elevada indicaría positivamente una baja actividad de la quinasa y, por tanto, marcaría las células en reposo con RNApII-pSer2", afirmó el profesor Neri. El análisis de espectrometría de masas confirmó la especificidad de la fosforilación.
El reportero de quinasa, denominado "OSCAR", tiene un rango dinámico significativamente mejorado en comparación con los sistemas anteriores basados en FRET y, por tanto, también puede utilizarse para la clasificación FACS de células intestinales en reposo y la microscopía de lapso de tiempo. Por ejemplo, utilizando la cripta del intestino delgado como modelo, OSCAR permitió detectar en tiempo real la dinámica de la inducción de la latencia y la diferenciación celular in vitro. Además, OSCAR logró identificar y aislar múltiples poblaciones de diferentes estados de OSCAR -de alto a bajo- en el organismo vivo (in vivo).
Hasta ahora, no se han detectado efectos tóxicos de la expresión de OSCAR en células de mamíferos ni en ratones. "Por tanto, prevemos que OSCAR podría resultar una herramienta útil para caracterizar las células quiescentes tanto in vitro como in vivo", dijo el profesor Neri, resumiendo los resultados del estudio. Así pues, OSCAR no sólo es una herramienta adecuada para comprender mejor la biología de las células madre inactivas. También es posible que este nuevo método facilite la detección de presuntas células madre cancerosas latentes en una población celular viva y, por tanto, su eliminación en una fase temprana.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.