Investigación farmacéutica: cuando el principio activo y la proteína diana se "abrazan"
Anuncios
Científicos de la Universidad Goethe de Fráncfort, junto con colegas de Darmstadt, Heidelberg, Oxford y Dundee (Reino Unido), han investigado cómo se puede optimizar el ajuste de potentes inhibidores a sus sitios de unión para que se enganchen durante más tiempo a sus proteínas objetivo. La permanencia prolongada en la diana se ha asociado a respuestas farmacológicas más eficaces, por ejemplo, en la terapia del cáncer. El resultado: Las estructuras de alta resolución revelaron que cuando la interacción entre los inhibidores y las proteínas diana dura mucho tiempo, las proteínas diana "anidan" contra los inhibidores. En el futuro, los investigadores quieren utilizar simulaciones informáticas para predecir el tiempo de permanencia de los inhibidores durante el desarrollo de los fármacos.
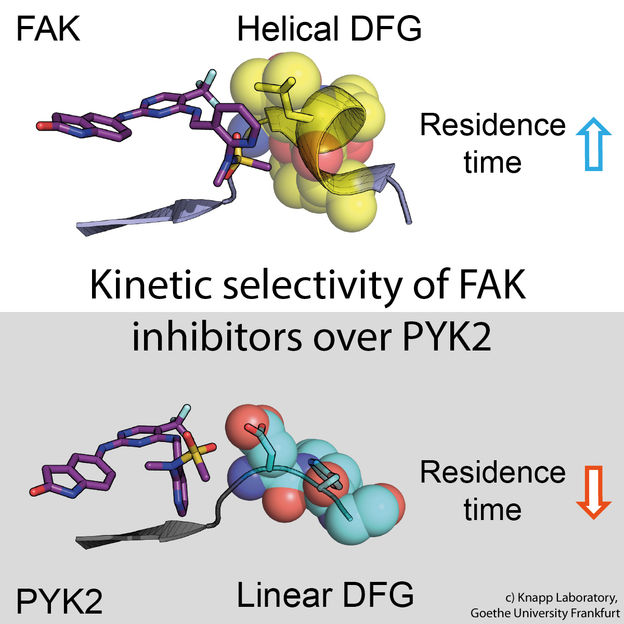
Parte superior: Tiempo de residencia prolongado. Un inhibidor (izquierda: modelo de palo) se une a la molécula de señal FAK (derecha: parte de la proteína FAK representada como modelo de calota con esferas). El cambio estructural de FAK provoca contactos hidrofóbicos (amarillo, el llamado motivo DFG) y un compromiso de larga duración. Parte inferior: Tiempo de permanencia corto. La proteína señal PYK2 no cambia su estructura al unirse al inhibidor, lo que da lugar a una rápida disociación del mismo.
Knapp Laboratory, Goethe-Universität Frankfurt
Muchos fármacos contra el cáncer bloquean las señales de las células cancerosas que ayudan a las células degeneradas a multiplicarse sin control y desprenderse del tejido. Por ejemplo, el bloqueo de la proteína de señalización FAK, una de las llamadas quinasas, hace que las células del cáncer de mama se vuelvan menos móviles y, por tanto, menos propensas a hacer metástasis. El problema es que cuando se bloquea la FAK con un inhibidor, la proteína de señalización PYK2, estrechamente relacionada con ella, se vuelve mucho más activa y asume así algunas de las tareas de la FAK. Lo ideal sería, por tanto, un inhibidor que inhibiera tanto a FAK como a PYK2 de la misma manera durante el mayor tiempo posible.
Un equipo internacional dirigido por el químico farmacéutico Stefan Knapp, de la Universidad Goethe, ha investigado una serie de inhibidores de FAK especialmente sintetizados. Todos los inhibidores se unieron a la proteína FAK aproximadamente a la misma velocidad. Sin embargo, difieren en la duración de la unión: El inhibidor más eficaz fue el que más tiempo permaneció unido a la proteína de señalización FAK.
Utilizando análisis estructurales y de biología molecular, así como simulaciones informáticas, el equipo de investigación descubrió que la unión de los inhibidores que permanecen en el bolsillo de unión de la FAK durante mucho tiempo induce un cambio estructural. Así, mediante la unión de estos inhibidores, la FAK cambia su forma y forma una estructura específica e hidrófuga en los lugares de contacto con el inhibidor, comparable a un abrazo íntimo.
La proteína estrechamente relacionada PYK2, en cambio, se mantuvo comparativamente rígida, y aunque el inhibidor de FAK más eficaz también bloqueó a PYK2, su efecto fue significativamente más débil debido a la rápida disociación de los inhibidores del sitio de unión. Curiosamente, las simulaciones por ordenador pudieron predecir muy bien la cinética de unión, proporcionando un método para la simulación precisa de las tasas de disociación de los fármacos para la futura optimización de los candidatos a fármacos.
El profesor Stefan Knapp explica: "Como ahora conocemos mejor los mecanismos moleculares de la interacción de potentes inhibidores de estas dos quinasas, esperamos poder utilizar las simulaciones por ordenador para predecir mejor los tiempos de permanencia de los inhibidores y los fármacos candidatos en el futuro. Hasta ahora, se ha prestado poca atención a las propiedades cinéticas de la unión de los fármacos. Sin embargo, esta propiedad ha surgido ahora como un parámetro importante para el desarrollo de fármacos más eficaces que estén diseñados para inhibir sus proteínas diana -como en el caso de FAK y PYK2- no sólo con potencia sino también durante mucho tiempo".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Benedict-Tilman Berger, Marta Amaral, Daria B. Kokh, Ariane Nunes-Alves, Djordje Musil, Timo Heinrich, Martin Schröder, Rebecca Neil, Jing Wang, Iva Navratilova, Joerg Bomke, Jonathan M. Elkins, Susanne Müller, Matthias Frech, Rebecca C. Wade, Stefan Knapp; "Structure-kinetic relationship reveals the mechanism of selectivity of FAK inhibitors over PYK2"; Cell Chemical Biology; 2021









































