Cómo las células se mueven y no se atascan
Nueva visión para la biología del desarrollo y el posible tratamiento del cáncer
Físicos teóricos de Berlín se unieron a físicos experimentales de Munich para determinar la mecánica precisa involucrada en la motilidad celular.
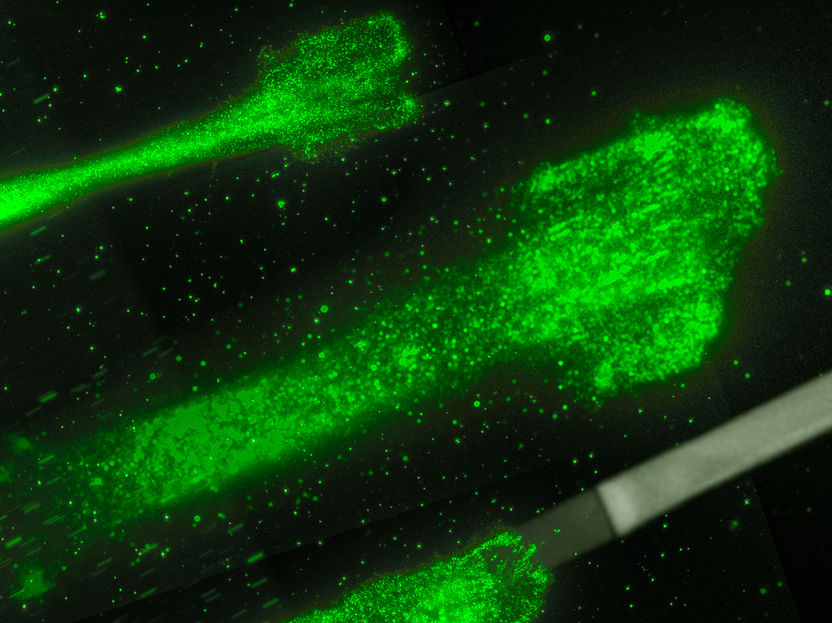
Células cancerígenas moviéndose en tiras de glicoproteína: Estas tiras actúan como tablillas, que permiten controlar y estudiar mejor el movimiento de las células.
AG Rädler, Ludwig-Maximilians-Universität München
Se sabe que la velocidad de las células, o la rapidez con que se mueven, depende de lo pegajosa que sea la superficie debajo de ellas, pero los mecanismos precisos de esta relación han permanecido esquivos durante décadas. Ahora, los investigadores del Centro Max Delbrück de Medicina Molecular de la Asociación Helmholtz (MDC) y de la Universidad Ludwig Maximilians de Munich (LMU) han descubierto la mecánica precisa y han desarrollado un modelo matemático que capta las fuerzas involucradas en el movimiento celular. Los hallazgos, publicados en la revista Proceedings of the National Academy of Sciences (PNAS), proporcionan nuevos conocimientos sobre la biología del desarrollo y el posible tratamiento del cáncer.
El movimiento celular es un proceso fundamental, especialmente crítico durante el desarrollo, cuando las células se diferencian en su tipo de célula objetivo y luego se trasladan al tejido correcto. Las células también se mueven para reparar heridas, mientras que las células cancerosas se arrastran hasta el vaso sanguíneo más cercano para propagarse a otras partes del cuerpo.
"El modelo matemático que desarrollamos puede ser utilizado ahora por los investigadores para predecir cómo se comportarán las diferentes células en diversos sustratos", dice el profesor Martin Falcke, que dirige el Laboratorio de Fisiología Celular Matemática de la MDC y codirige la investigación. "Entender estos movimientos básicos con detalles precisos podría proporcionar nuevos objetivos para interrumpir la metástasis del tumor".
Se unen para precisar
El hallazgo se debe a que los físicos experimentales de la LMU se asociaron con los físicos teóricos del MDC. Los experimentadores, dirigidos por el Profesor Joachim Rädler, rastrearon la rapidez con la que más de 15.000 células cancerosas se movían por carriles estrechos en una superficie pegajosa, donde la pegajosidad alternaba entre baja y alta. Esto les permitió observar lo que ocurre cuando las células pasan de un nivel de adherencia a otro, lo que es más representativo del entorno dinámico dentro del cuerpo.
Luego, Falcke y Behnam Amiri, co-autor del artículo y estudiante de doctorado en el laboratorio de Falcke, utilizaron el gran conjunto de datos para desarrollar una ecuación matemática que captura los elementos que conforman la motilidad celular.
"Los modelos matemáticos anteriores que tratan de explicar la migración y la motilidad de las células son muy específicos, sólo funcionan para una característica o tipo de célula", dice Amiri. "Lo que intentamos hacer aquí es mantenerlo tan simple y general como sea posible".
El enfoque funcionó incluso mejor de lo esperado: el modelo coincidió con los datos reunidos en LMU y se mantuvo para las mediciones sobre varios otros tipos de células tomadas en los últimos 30 años. "Esto es emocionante", dice Falcke. "Es raro que encuentres una teoría que explique un espectro tan grande de resultados experimentales."
La fricción es la clave
Cuando una célula se mueve, empuja su membrana en la dirección del viaje, expandiendo una red interna de filamentos de actina a medida que avanza, y luego se desprende de su extremo posterior. La rapidez con la que esto ocurre depende de los enlaces de adhesión que se forman entre la célula y la superficie que está debajo de ella. Cuando no hay enlaces, la célula apenas puede moverse porque la red de actina no tiene nada contra lo que empujar. La razón es la fricción: "Cuando estás sobre patines de hielo no puedes empujar un coche, sólo cuando hay suficiente fricción entre tus zapatos y el suelo puedes empujar un coche", dice Falcke.
A medida que aumenta el número de uniones, creando más fricción, la célula puede generar más fuerza y moverse más rápido, hasta el punto en que es tan pegajoso que se hace mucho más difícil de sacar la parte trasera, frenando la célula de nuevo.
Lento, pero no pegado
Los investigadores investigaron lo que sucede cuando la parte delantera y trasera de la célula experimentan diferentes niveles de pegajosidad. Tenían especial curiosidad por saber qué sucede cuando es más pegajoso bajo la parte trasera de la célula que la delantera, porque es entonces cuando la célula podría potencialmente atascarse, incapaz de generar suficiente fuerza para sacar la parte trasera.
Este podría haber sido el caso si las uniones de adhesión fueran más como tornillos, sujetando la célula al sustrato. Al principio, Falcke y Amiri incluyeron este tipo de fuerza "elástica" en su modelo, pero la ecuación sólo funcionaba con fuerzas de fricción.
"Para mí, la parte más difícil fue envolver mi mente alrededor de este mecanismo que sólo funciona con fuerzas de fricción", dice Falcke, porque no hay nada para que la célula se adhiera firmemente. Pero son las fuerzas de fricción las que permiten que la célula siga moviéndose, incluso cuando los lazos son más fuertes en la parte trasera que en la delantera, despegándose lentamente como la cinta adhesiva. "Incluso si se tira un poco con una fuerza débil, todavía se puede despegar la cinta, muy lentamente, pero se desprende", dice Falcke. "Así es como la célula evita que se atasque".
El equipo está investigando ahora cómo las células se mueven en dos dimensiones, incluyendo cómo hacen giros bruscos a la derecha y a la izquierda, y giros en U.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.










































