Cómo los chaperones moleculares disuelven los agregados proteicos vinculados a la enfermedad de Parkinson
Los investigadores desentrañan el mecanismo de desagregación de las fibrillas amiloides
En muchas enfermedades neurodegenerativas como el Parkinson, los agregados de proteínas se forman en el cerebro y se supone que contribuyen a la muerte de las células neuronales. Sin embargo, existe un mecanismo de defensa celular que contrarresta estos agregados, conocido como fibrillas amiloides, e incluso puede disolver las fibrillas ya formadas. Este mecanismo de defensa se basa en la actividad de los chaperones moleculares, es decir, los ayudantes de plegado de proteínas, de la familia de las proteínas de choque térmico 70 (Hsp70). Biólogos moleculares de la Universidad de Heidelberg y del Centro Alemán de Investigación del Cáncer investigaron cómo el sistema Hsp70 disuelve las fibrillas amiloides de la proteína específica del Parkinson α-sinucleína en un tubo de ensayo. El equipo de investigación dirigido por el Prof. Dr. Bernd Bukau espera que los resultados de su investigación proporcionen nuevos conocimientos sobre cómo se desarrolla la enfermedad de Parkinson y qué podría hacerse para influenciarla. Los resultados fueron publicados en dos artículos en la revista "Nature".
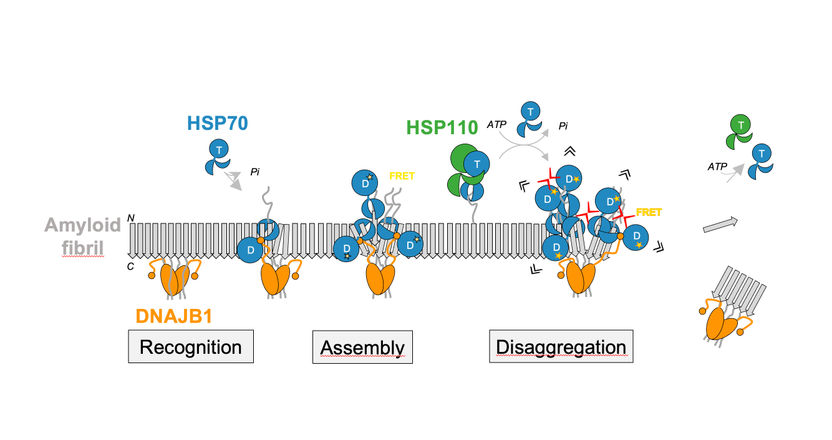
La desagregación de las fibrillas amiloides de sinucleína α se basa en la cooperación del chaperón HSP70 con sus co-chaperones DNAJB1 y HSP110.
Bernd Bukau, Heidelberg University
Las proteínas de todas las células, desde las bacterias hasta los humanos, necesitan plegarse a su estado nativo. Las cadenas de bloques de aminoácidos asumen estructuras tridimensionales específicas que dan a las proteínas su funcionalidad. Este estado de plegado correcto está constantemente amenazado por influencias externas e internas que pueden conducir a proteínas mal plegadas y por lo tanto dañadas. Existe el riesgo de que las proteínas dañadas se "agreguen" o se agrupen en cadenas más largas, las fibrillas amiloides. Esto sucede con α-sinucleína en la enfermedad de Parkinson, por ejemplo. Las fibrillas, a su vez, son el punto de partida de depósitos aún más grandes". El proceso de formación de tales agregados fibrilares puede dañar las células e incluso llevar a la muerte celular, como es el caso de las enfermedades neurodegenerativas como el Parkinson y el Alzheimer", explica el Prof. Bukau, investigador del Centro de Biología Molecular de la Universidad de Heidelberg (ZMBH) y del Centro Alemán de Investigación del Cáncer (DKFZ).
La investigación del Prof. Bukau se enfoca en cómo estos agregados de proteínas pueden ser disueltos. En trabajos anteriores, él y su equipo lograron identificar una actividad celular que juega un papel vital en la disolución de los agregados fibrilares, que se basa en los chaperones de la familia Hsp70. Las carabinas Hsp70 ayudan a otras proteínas a doblarse e incluso pueden aislar y volver a doblar las proteínas agregadas. La última investigación del Prof. Bukau y la Dra. Anne Wentink, postdoctora, muestra los efectos que los chaperones Hsp70 tienen en las fibrillas amiloides específicas del Parkinson de la proteína α-sinucleína. α-sinucleína es una pequeña proteína que ayuda en la liberación de mensajeros llamados neurotransmisores en el cerebro, aunque su función exacta sigue sin estar clara. Se dio a conocer porque se encontraron depósitos masivos de esta proteína específica en pacientes con Parkinson y se ha relacionado causalmente con la enfermedad.
En experimentos bioquímicos, los científicos de Heidelberg pudieron demostrar recientemente que el chaperón Hsp70 humano depende de la asistencia de dos compañeros específicos para disolver las fibrillas amiloides de la proteína α-sinucleína. Una interacción regulada con precisión de estas proteínas conduce a la formación de complejos de chaperonas en la superficie de las fibrillas, que luego rompen los agregados. "Es la acumulación local de muchas proteínas de chaperona en la superficie de las fibrillas de α-sinucleína lo que genera la fuerza para romper las fibrillas y separar las moléculas de α-sinucleína", explica el Dr. Wentink. La estrecha proximidad entre los chaperones en la superficie restringida de las fibrillas juega un papel decisivo en la creación de fuerzas de tracción lo suficientemente fuertes como para romper las fibrillas.
Los experimentos se llevaron a cabo junto con colegas del Laboratorio Europeo de Biología Molecular (EMBL) de Heidelberg, el Centro de Biología Estructural de Montpellier (Francia) y la Escuela Politécnica Federal de Lausana (Suiza). El proyecto fue financiado por el programa "Top Research" de la Fundación Baden-Württemberg, la Fundación Alemana de Investigación y la Asociación Helmholtz.
El segundo estudio publicado en "Nature" se centra en un mecanismo regulador previamente desconocido, un tipo de interruptor molecular que pone en marcha la actividad general de los chaperones Hsp70 para disolver las fibrillas amiloides. Este mecanismo se basa en una secuencia de interacciones directas entre las diferentes partes de la co-caperona DNAJB1 y la chaperona Hsp70. En última instancia, esto activa a la Hsp70 para utilizar el ATP como fuente de energía, haciendo posible que se una productivamente a las fibrillas y efectúe su desintegración. Una estrecha colaboración de investigación de la Dra. Rina Rosenzweig del Instituto de Ciencia Weizman en Rehovot (Israel) y el Prof. Bukau, el Dr. Wentink y la Dra. Nadinath Nillegoda de la Universidad de Monash en Melbourne (Australia) - un ex becario de la Fundación Alexander von Humboldt en el grupo de investigación de Bernd Bukau - logró identificar este mecanismo.
"Nuestros últimos resultados de los dos estudios nos dan una comprensión molecular de cómo se disuelven las fibrillas amiloides. Pudimos demostrar que los chaperones funcionan como una máquina para disolver las fibrillas", añade el Prof. Bukau. Según el investigador de Heidelberg, esto abre nuevas vías para el desarrollo de agentes que se dirigen específicamente al mecanismo de defensa celular basado en los chaperones contra la formación de amiloide. Así pues, una mejor comprensión de la forma en que esta actividad de los chaperones influye en el curso de las enfermedades neurodegenerativas tendrá una importancia esencial en la explotación terapéutica de los hallazgos descritos en estos estudios.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
A.S. Wentink, N.B. Nillegoda, J. Feufel, G. Ubartait, C.P. Schneider, P. De Los Rios, J. Hennig, A. Barducci, B. Bukau; "Molecular dissection of amyloid disaggregation by the human Hsp70 chaperone"; Nature; 2020.
O. Faust, M. Abayev-Avraham, A.S. Wentink, M. Maurer, N.B. Nillegoda, N. London, B. Bukau, R. Rosenzweig; "Hsp40s employ class-specific regulation to drive Hsp70 functional diversity"; Nature; 2020









































