Se trata del equilibrio correcto
Los nuevos hallazgos proporcionan un marco estructural para el desarrollo de nuevas estrategias terapéuticas para el cáncer y el descubrimiento de drogas
La colaboración de grupos de investigación de la Universidad de Würzburg y de la Universidad Técnica de Dresde ha proporcionado nuevos e importantes conocimientos para la investigación del cáncer. Durante la división celular, las proteínas diana específicas tienen que ser volteadas de una manera regulada con precisión. Para ello, enzimas especializadas etiquetan las proteínas diana con moléculas de señalización. Sin embargo, las enzimas involucradas en este proceso también pueden etiquetarse a sí mismas, iniciando así su propia degradación. En un enfoque multidisciplinario, los investigadores identificaron un mecanismo de cómo las enzimas pueden protegerse de esa autodestrucción y mantener concentraciones suficientes en la célula.

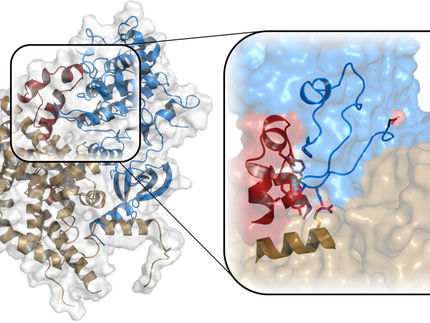
Una visión surrealista de la enzima UBE2S, que regula su vida útil cambiando entre un estado monomérico y uno dimérico.
© Anna Liess
Las funciones vitales de los organismos multicelulares, como el crecimiento, el desarrollo y la regeneración de los tejidos, dependen de la división de las células, controlada con precisión. Una falla en los mecanismos de control subyacentes puede conducir al cáncer. Un equipo de investigadores dirigidos por la Dra. Sonja Lorenz del Centro Rudolf Virchow - Centro de Bioimágenes Integrativas y Translacionales de la Universidad de Würzburg y por el Dr. Jörg Mansfeld del Centro de Biotecnología (BIOTEC) de la Universidad Técnica de Dresde descubrió un nuevo mecanismo que modula la división celular.
La ubicuidad - un elemento regulador central
Un paso crítico en la división celular es la distribución de la información genética de manera uniforme entre las células hijas. Este proceso está controlado por un gran complejo proteico, el complejo/ciclosoma promotor de la anafase (APC/C), que etiqueta a las proteínas con una molécula de señalización conocida como "ubiquitina". La etiqueta de ubiquitina funciona esencialmente como un código postal molecular, dirigiendo las proteínas etiquetadas a la maquinaria celular de degradación de proteínas. Para permitir un etiquetado eficiente y preciso de las proteínas objetivo, el APC/C trabaja junto con una enzima que conjuga la ubiquitina, la UBE2S. Sin embargo, UBE2S también tiene la capacidad de modificarse a sí misma con la ubiquitina, iniciando así su propia degradación. Esta capacidad se aplica a las enzimas de ubiquitinación en general. "Esto plantea la cuestión fundamental de cómo las enzimas de ubiquitinación encuentran el equilibrio adecuado entre el etiquetado de sus objetivos y el etiquetado de sí mismas para garantizar que en la célula se disponga de cantidades suficientes de las enzimas", dice Sonja Lorenz.
El cambio entre los estados activo e inactivo
El nuevo estudio da respuesta a esta pregunta demostrando que el UBE2S puede adoptar un estado inactivo en el que es incapaz de etiquetarse con ubiquitina. "Cuando el UBE2S forma un dímero, es decir, dos moléculas se emparejan entre sí, se vuelven inactivas y se protegen de la autodestrucción", dice Jörg Mansfeld. Los científicos sugieren que este mecanismo asegura que un pool celular estable de UBE2S se preserve y se reactive cuando sea necesario. La célula puede así controlar la proporción de UBE2S activo e inactivo para afinar la división celular. Estos hallazgos proporcionan un marco estructural para el desarrollo de nuevas estrategias terapéuticas contra el cáncer y el descubrimiento de fármacos.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.