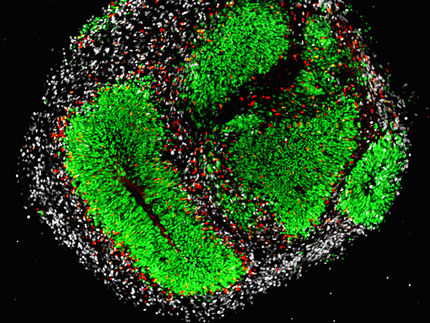
Las prisiones enzimáticas
Un equipo del MDC ha respondido a una pregunta que ha desconcertado a los científicos durante unos 40 años
En la revista Cell, el grupo explica cómo las células son capaces de activar vías de señalización completamente diferentes utilizando una sola molécula de señalización: el nucleótido cAMP. Para lograr esto, la molécula está virtualmente aprisionada en espacios de tamaño nanométrico.

Los barcos de movimiento lento en mar abierto sirven para ilustrar la limitada dinámica del CAMP. Los remolinos representan los nanodominios del CAMP alrededor de los EDP.
Charlotte Konrad, MDC
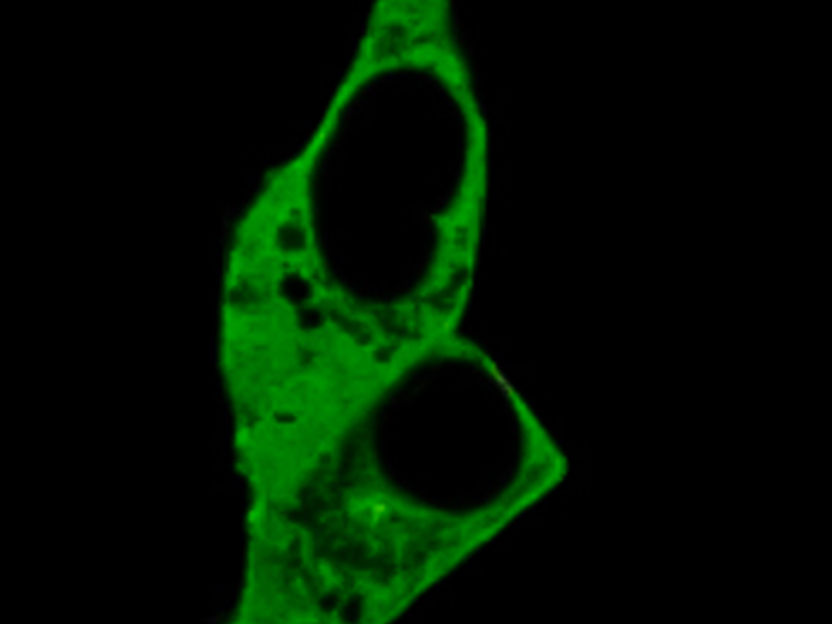
La imagen confocal muestra células que expresan una de las nanorreguladoras de nuevo diseño para trazar los gradientes del cAMP de tamaño nanométrico en células intactas.
Paolo Annibale, MDC

Hay hasta cien receptores diferentes en la superficie de cada célula del cuerpo humano. La célula utiliza estos receptores para recibir señales extracelulares, que luego transmite a su interior. Tales señales llegan a la célula en varias formas, incluyendo como percepciones sensoriales, neurotransmisores como la dopamina, u hormonas como la insulina.
Una de las moléculas de señalización más importantes que la célula utiliza para transmitir tales estímulos a su interior, que luego desencadena las correspondientes vías de señalización, es una pequeña molécula llamada cAMP. Este llamado segundo mensajero fue descubierto en la década de 1950. Hasta ahora, las observaciones experimentales han supuesto que el cAMP se difunde libremente -es decir, que su concentración es básicamente la misma en toda la célula- y que, por lo tanto, una sola señal debe abarcar toda la célula.
"Pero desde principios de la década de 1980 hemos sabido, por ejemplo, que dos receptores diferentes de células cardíacas liberan exactamente la misma cantidad de cAMP cuando reciben una señal externa, sin embargo, se producen efectos completamente diferentes dentro de la célula", informa el Dr. Andreas Bock. Junto con el Dr. Paolo Annibale, Bock dirige temporalmente el Laboratorio de Señalización de Receptores del Centro Max Delbrück de Medicina Molecular de la Asociación Helmholtz (MDC) en Berlín.
Como los agujeros en un queso suizo
Bock y Annibale, que son los dos autores principales del estudio, han resuelto esta aparente contradicción, que ha preocupado a los científicos durante casi cuarenta años. El equipo informa ahora en Cell que, contrariamente a las suposiciones anteriores, la mayoría de las moléculas de cAMP no pueden moverse libremente en la célula, sino que en realidad están unidas a ciertas proteínas - particularmente a las proteínas cinasas. Además de los tres científicos y el profesor Martin Falcke del MDC, en el proyecto de investigación participaron otros investigadores de Berlín, así como científicos de Würzburg y Minneapolis.
"Debido a esta unión de proteínas, la concentración de AMPc libre en la célula es en realidad muy baja", dice el profesor Martin Lohse, último autor del estudio y antiguo jefe del grupo. "Esto le da a las enzimas de degradación del AMPc, las fosfodiesterasas (PDEs), suficiente tiempo para formar compartimentos de tamaño nanométrico a su alrededor que están casi libres de AMPc". La molécula de señalización se regula por separado en cada uno de estos pequeños compartimentos. "Esto permite a las células procesar diferentes señales receptoras simultáneamente en muchos de estos compartimentos", explica Lohse. Los investigadores pudieron demostrarlo utilizando el ejemplo de la proteína quinasa A dependiente de cAMP (PKA), cuya activación en diferentes compartimentos requería diferentes cantidades de cAMP.
"Se pueden imaginar estos compartimentos despejados más bien como los agujeros de un queso suizo - o como pequeñas prisiones en las que el PDE, que en realidad funciona con bastante lentitud, vigila el cAMP, que es mucho más rápido, para asegurarse de que no se rompe y desencadena efectos no deseados en la celda", explica Annibale. "Una vez que el perpetrador es encerrado, la policía ya no tiene que perseguirlo."
Las mediciones a escala nanométrica
El equipo identificó los movimientos de la molécula de señalización en la célula utilizando moléculas fluorescentes de cAMP y métodos especiales de espectroscopia de fluorescencia -incluyendo espectroscopia de fluctuación y anisotropía- que Annibale desarrolló aún más para el estudio. Las llamadas nanorreguladoras ayudaron al grupo a medir el tamaño de los agujeros en los que el cAMP activa determinadas vías de señalización. "Estas son proteínas alargadas que fuimos capaces de utilizar como una pequeña regla", explica Bock, que inventó esta nanorreguladora en particular.
Las mediciones del equipo mostraron que la mayoría de los compartimentos son en realidad más pequeños que 10 nanómetros, es decir, 10 millonésimas de milímetro. De esta manera, la célula es capaz de crear miles de dominios celulares distintos en los que puede regular el cAMP por separado y así protegerse de los efectos no deseados de la molécula de señalización. "Fuimos capaces de mostrar que una vía de señalización específica fue inicialmente interrumpida en un agujero que estaba virtualmente libre de AMPc", dijo Annibale. "Pero cuando inhibimos los EDP que crean estos agujeros, la vía continuó sin obstruirse".
Un chip en lugar de un interruptor
"Esto significa que la célula no actúa como un simple interruptor de encendido/apagado, sino como un chip entero que contiene miles de tales interruptores", explica Lohse, resumiendo los hallazgos de la investigación. "El error cometido en los experimentos anteriores fue utilizar concentraciones de cAMP que eran demasiado altas, permitiendo así que una gran cantidad de la molécula de señalización se difundiera libremente en la célula porque todos los sitios de unión estaban ocupados".
Como siguiente paso, los investigadores quieren seguir investigando la arquitectura de las "prisiones" de cAMP y descubrir qué EDP protegen qué proteínas de señalización. En el futuro, la investigación médica también podría beneficiarse de sus hallazgos. "Muchos medicamentos funcionan alterando las vías de señalización dentro de la célula", explica Lohse. "Gracias al descubrimiento de esta compartimentación celular, ahora sabemos que hay muchos más objetivos potenciales que pueden ser buscados".
"Un estudio de San Diego, que se publicó al mismo tiempo que nuestro artículo en Cell, muestra que las células comienzan a proliferar cuando sus vías de señalización individuales ya no están reguladas por la separación espacial", dice Bock. Además, añade, ya se sabe que la distribución de los niveles de concentración de cAMP en las células cardíacas cambia en la insuficiencia cardíaca, por ejemplo. Por lo tanto, su trabajo podría abrir nuevas vías tanto para la investigación del cáncer como para la investigación cardiovascular.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.