Método de secuenciación de ARN unicelular desarrollado para cuantificar con precisión los efectos de los medicamentos específicos de las células en los islotes pancreáticos
Los hallazgos podrían abrir potenciales vías terapéuticas para tratar la diabetes de tipo 1
Los investigadores de los grupos de Stefan Kubicek y Christoph Bock, del Centro de Investigación de Medicina Molecular del CeMM de la Academia Austríaca de Ciencias de Viena, han desarrollado un método para evaluar con precisión el efecto de fármacos específicos en el tejido pancreático aislado utilizando un método refinado de secuenciación de ARN unicelular. Su estudio publicado en Genome Biology describe la técnica que han desarrollado para superar el problema de las moléculas de ARN contaminantes en la transcriptómica unicelular, que permitió obtener resultados precisos de las respuestas dinámicas de los fármacos en las células pancreáticas. Estos hallazgos apoyarán el desarrollo de terapias farmacológicas específicas para el tratamiento de la diabetes de tipo 1 en el futuro.
Resumen gráfico
B. Marquina-Sánchez N. Fortelny
El páncreas es un órgano abdominal que produce enzimas digestivas, así como hormonas que regulan los niveles de azúcar en la sangre. Esta función productora de hormonas se localiza en los islotes de Langerhans, que constituyen grupos de diferentes tipos de células endocrinas. Entre ellas se encuentran las células beta, que producen la hormona insulina necesaria para reducir los niveles de glucosa (un tipo de azúcar) en nuestra sangre, así como las células alfa, que generan la hormona glucagón encargada de aumentar los niveles de glucosa en la sangre.
La diabetes de tipo 1 es una enfermedad crónica en la que el sistema inmunológico del cuerpo ataca y destruye por error las células beta productoras de insulina del páncreas. La medicina regenerativa tiene como objetivo reponer la masa de células beta, y así apoyar y finalmente sustituir las actuales terapias de reemplazo de insulina. Las alteraciones en la composición de los islotes, incluida la función insuficiente de las células beta y la deducción de las células beta, también contribuyen a la diabetes de tipo II. Por lo tanto, una comprensión más profunda de la identidad y la interrelación de los diferentes tipos de células de los islotes conduce a una mejor caracterización de ambas formas de diabetes y puede contribuir al desarrollo de nuevos conceptos terapéuticos.
La transcriptómica unicelular es una poderosa técnica para caracterizar la identidad celular. Anteriormente, los investigadores del CeMM de los grupos de Christoph Bock y Stefan Kubicek en el CeMM publicaron los primeros transcriptomas de células únicas de las células primarias de los islotes del páncreas humano (EMBO Rep. 2016 Feb 17;(2):178-87). Los avances en la tecnología han permitido desde entonces su aplicación a la generación de atlas globales de transcriptomas unicelulares humanos y de ratones. A pesar de estos avances, los enfoques de célula única siguen siendo un desafío tecnológico, ya que la minúscula cantidad de ARN presente se ha agotado por completo en el experimento. Por lo tanto, es esencial asegurar la calidad y la pureza de los transcriptomas unicelulares resultantes.
Los investigadores del CeMM de los dos laboratorios que contribuyeron identificaron una expresión hormonal inesperadamente alta en tipos de células no endocrinas, tanto en su propio conjunto de datos como en otros estudios de células únicas publicados. Se propusieron dilucidar si esto sería el resultado de la contaminación por moléculas de ARN, por ejemplo, de células moribundas, y cómo se podría eliminar para obtener un conjunto de datos más fiable. Dicha contaminación parece estar presente en los datos de ARN unicelular-seq. de la mayoría de los tejidos, pero era más visible en los islotes pancreáticos. Las células endocrinas de los islotes se dedican exclusivamente a la producción de hormonas simples, y la insulina en las células beta y el glucagón en las células alfa se expresan en niveles más altos que los genes típicos de "mantenimiento". Por lo tanto, la redistribución de estas transcripciones a otros tipos de células fue muy pronunciada. Basándose en esta observación, su objetivo era desarrollar, validar y aplicar un método para determinar experimentalmente y eliminar computacionalmente dicha contaminación.
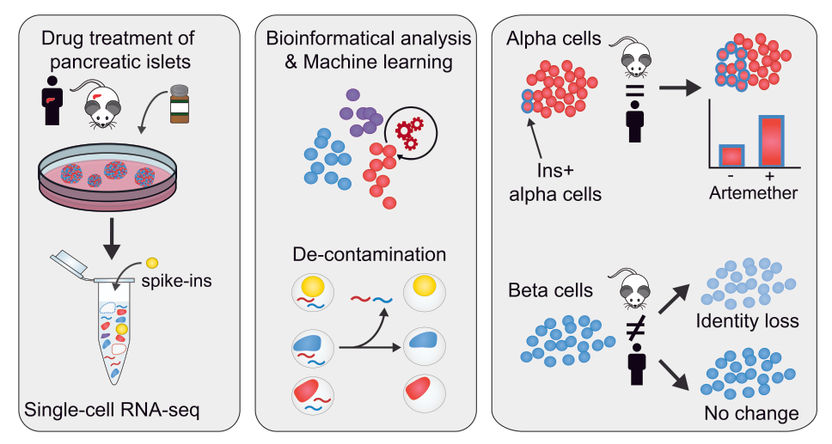
En su investigación, los investigadores del CeMM utilizaron células de diferentes tipos de células, tanto de ratones como de humanos, que añadieron a sus muestras de islotes pancreáticos. Es importante destacar que los transcriptomas de estas células "spike-in" fueron totalmente caracterizados. Esto les permitió controlar internamente y con precisión el nivel de contaminación de ARN en el ARN-secuencia de una sola célula, dado que los transcriptos humanos detectados en las células de refuerzo de los ratones constituyen ARN contaminante. De esta manera, encontraron que las muestras tenían un nivel de contaminación de hasta el 20%, y fueron capaces de definir la contaminación en cada muestra. Luego desarrollaron un novedoso enfoque bioinformático para eliminar computacionalmente las lecturas contaminantes de los transcriptomas de una sola célula.
Tras obtener un transcriptoma "descontaminado", del que se ha eliminado la señal espuria, procedieron a caracterizar la forma en que la identidad celular en los diferentes tipos de células respondía al tratamiento con tres fármacos diferentes. Descubrieron que un pequeño inhibidor de moléculas del factor de transcripción FOXO1 induce la desdiferenciación de las células alfa y beta. Además, estudiaron el artemetero, que se había descubierto que disminuía la función de las células alfa y podía inducir la producción de insulina tanto en estudios in vivo como in vitro (Cell. 2017 Jan 12;168(1-2):86-100.e15). Los efectos de la droga arteméter eran específicos de la especie y del tipo de célula. En las células alfa, una fracción de las células aumenta la expresión de insulina y adquiere aspectos de la identidad de las células beta, tanto en muestras de ratones como de seres humanos. Es importante señalar que los investigadores descubrieron que en las células beta humanas no hay un cambio significativo en la expresión de insulina, mientras que en los islotes de ratones, las células beta reducen su expresión de insulina y la identidad general de las células beta.
Este estudio es el resultado de una colaboración interdisciplinaria de los laboratorios de Stefan Kubicek y Christoph Bock en el CeMM con Patrick Collombat en el Instituto de Biología de Valrose (Francia). Se trata del primer estudio que aplica la secuenciación de células individuales para analizar la respuesta dinámica a las drogas en el tejido aislado intacto, que se benefició de la alta precisión cuantitativa del método de descontaminación. Así pues, no sólo proporciona un método novedoso para la descontaminación de células individuales y un análisis unicelular altamente cuantitativo de las respuestas a los medicamentos en tejidos intactos, sino que también aborda una importante cuestión de actualidad en la biología de las células de los islotes y la investigación sobre la diabetes. Estos hallazgos podrían abrir posibles vías terapéuticas para tratar la diabetes de tipo 1 en el futuro.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.









































