En el camino a los nanoteranósticos
La teranosis es un campo emergente de la medicina cuyo nombre es una combinación de "terapéutica" y "diagnóstico". La idea detrás de la teranosis es combinar medicamentos y/o técnicas para diagnosticar y tratar condiciones médicas simultáneamente -o secuencialmente-, y también monitorear la respuesta del paciente. Esto ahorra tiempo y dinero, pero también puede evitar algunos de los efectos biológicos indeseables que pueden surgir cuando estas estrategias se emplean por separado.
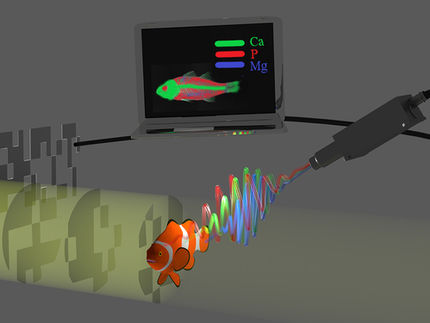
La excitación en infrarrojo cercano de nanopartículas de ferrita de bismuto funcionalizadas resulta en una emisión armónica que desencadena la liberación de cargas moleculares enjauladas, permitiendo aplicaciones de imagenología desacoplada y entrega controlada.
S. Gerber (EPFL)
Hoy en día, las aplicaciones de la teranosis utilizan cada vez más nanopartículas que unen moléculas de diagnóstico y fármacos en un solo agente. Las nanopartículas actúan como portadoras de "carga" molecular, por ejemplo, un fármaco o un radioisótopo para pacientes con cáncer que se someten a radioterapia, dirigiéndose a vías biológicas específicas en el cuerpo del paciente, al tiempo que evitan dañar los tejidos sanos.
Una vez en su tejido objetivo, las nanopartículas producen imágenes de diagnóstico y/o entregan su carga. Se trata de la tecnología de vanguardia de los "nanoteranósticos", que se ha convertido en uno de los principales focos de investigación, aunque con muchas limitaciones que superar.
Ahora, el laboratorio de Sandrine Gerber de la EPFL, que trabaja con físicos de la Universidad de Ginebra, ha desarrollado un nuevo sistema nanoteranóstico que supera varios problemas con enfoques anteriores. El sistema utiliza "nanopartículas armónicas" (HNPs), una familia de nanocristales de óxido metálico con propiedades ópticas excepcionales, en particular su emisión en respuesta a la excitación de la luz ultravioleta a la luz infrarroja, y su alta fotoestabilidad. Fue esta característica la que llevó a los PNH a la nanoteranóstica, cuando los científicos estaban tratando de resolver algunos problemas con sondas fluorescentes.
"La mayoría de los sistemas nanoteranósticos activados por luz necesitan luz UV de alta energía para excitar sus andamios sensibles a la luz", dice Gerber. "El problema es que esto resulta en una profundidad de penetración pobre y puede dañar células y tejidos vivos, lo que limita las aplicaciones biomédicas."
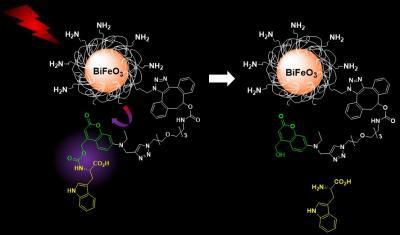
El nuevo sistema desarrollado por el grupo de Gerber evita estos problemas mediante el uso de HNPs recubiertos de silicona y ferrita de bismuto, funcionalizados con cargas moleculares enjauladas sensibles a la luz. Estos sistemas pueden activarse fácilmente con luz infrarroja cercana (longitud de onda 790 nanómetros) y pueden ser visualizados a mayor longitud de onda tanto para procesos de detección como de liberación de fármacos. Ambas características hacen que el sistema sea médicamente seguro para los pacientes.
Una vez que se activan con luz, los HNPs liberan su carga - en este caso, el L-triptófano, utilizado como modelo. Los científicos monitorearon y cuantificaron la liberación con una técnica que combina la cromatografía de líquidos y la espectrometría de masas, cubriendo la parte de diagnóstico por imágenes del sistema nanoteranóstico.
Los autores afirman que "este trabajo es un paso importante en el desarrollo de plataformas de nanocomponentes que permiten la imagenología desacoplada en la profundidad de los tejidos y la liberación bajo demanda de la terapéutica".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.
Publicación original
Jérémy Vuilleumier, Geoffrey Gaulier, Raphaël De Matos, Daniel Ortiz, Laure Menin, Gabriel Campargue, Christophe Mas, Samuel Constant, Ronan Le Dantec, Yannick Mugnier, Luigi Bonacina, Sandrine Gerber-Lemaire; "Two-photon triggered photorelease of caged compounds from multifunctional harmonic nanoparticles"; ACS Applied Materials and Interfaces; 05 July 2019