Neues Verfahren vermisst aktive Zentren von Proteinen
Anzeigen
Mit einer speziellen Methode für gepulste EPR-Spektroskopie bei hohen Magnetfeldern gelang es Wissenschaftlern der Universität Frankfurt sowie der Max-Planck-Institute für Biophysikalische Chemie (Göttingen) und Bioanorganische Chemie (Mülheim an der Ruhr) erstmals, die genaue Orientierung der aktiven Zentren eines Proteinkomplexes zu vermessen. Mit Hilfe der neuen Technik konnten die Forscher die Struktur des Proteins Ribonukleotid-Reduktase genauer bestimmen, welches eine Schlüsselrolle beim Bau der Erbsubstanz in jeder lebenden Zelle spielt. Die Erkenntnisse der Wissenschaftler ermöglichen neue Einblicke in die Struktur und Funktionsweise dieses lebenswichtigen Proteins. Von einem besseren Verständnis der Arbeitsweise des Proteins könnte zukünftig auch die medizinische Forschung profitieren, um Krebsmedikamente weiterzuentwickeln.
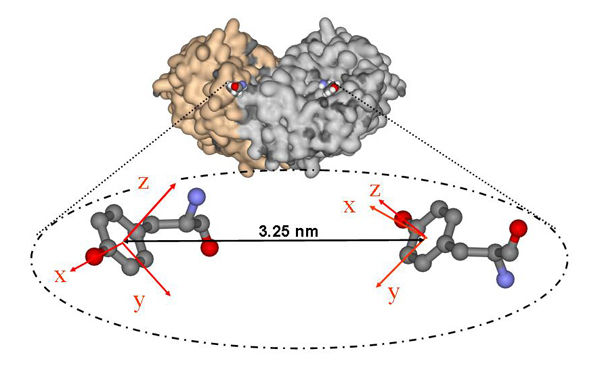
Mit der neuen Methode der Hochfeld-Elektronenspinresonanz-Spektroskopie gelang es Dr. Marina Bennati und ihren Kollegen, die Ausrichtung der beiden aktiven Zentren eines lebenswichtigen Proteinkomplexes zu vermessen. Das dazu eingesetzte Spektrometer wurde in der Arbeitsgruppe von Prof. Thomas Prisner an der Universität Frankfurt entwickelt.
Max-Planck-Institut für biophysikalische Chemie
Als es James Watson und Francis Crick 1953 gelang, die Struktur der Erbsubstanz (der DNA) aufzuklären, war nur wenig darüber bekannt, wie diese in den Zellen zusammengebaut wird. Erst acht Jahre später entdeckten Wissenschaftler mit der Ribonukleotid-Reduktase (RNR) ein erstes Protein, welches für den Bau der DNA von entscheidender Bedeutung ist. Von den Bakterien bis hin zum Menschen übernimmt die RNR den letzten Schritt bei der Bildung der einzelnen DNA-Bausteine. Dabei schließen sich häufig zwei RNR-Proteine zu einem Komplex zusammen. Doch ist die Funktionsweise dieses Proteinkomplexes noch nicht vollständig verstanden - nicht zuletzt deshalb, weil sich die RNR-Proteine nicht ohne weiteres in Aktion beobachten lassen.
Dr. Marina Bennati, Forschungsgruppenleiterin am Göttinger Max-Planck-Institut für biophysikalische Chemie, gelang es nun, den Proteinkomplex direkt in Aktion zu vermessen. Dazu arbeitete die Wissenschaftlerin eng mit Kollegen der Universität Frankfurt und des Max-Planck-Instituts für Bioanorganische Chemie zusammen. Erstmalig setzten die Forscher eine neue hochsensitive Methode der Hochfeld-Elektronenspinresonanz-Spektroskopie ein, um die Bewegung und die Struktur der RNR zu untersuchen. "Mit Hilfe dieser neuen Technik können wir aktive Proteinkomplexe unter nahezu natürlichen Bedingungen messen, wie sie auch in der lebenden Zelle vorliegen", erklärt Bennati. Dabei machen sich die Wissenschaftler zunutze, dass der Proteinkomplex in seinen beiden aktiven Zentren je eine aktivierte Aminosäure enthält.
"Mit Hilfe der Elektronenspinresonanz-Spektroskopie messen wir nicht nur den Abstand zwischen den beiden aktivierten Aminosäuren, sondern sehen auch ihre relative Orientierung", erklärt die Projektleiterin. Die Methode gibt den Wissenschaftlern dabei nicht nur ein genaueres Bild der Proteinstruktur, sondern erlaubt ihnen auch neue Einblicke in die Funktionsweise des Proteinkomplexes. Entwickelt wurde das dazu verwendete Spektrometer in der Arbeitsgruppe von Professor Thomas Prisner an der Universität Frankfurt.
Proteine in aktivem Zustand in hoher räumlicher und zeitlicher Präzision zu studieren, ist nicht nur für die Grundlagenforschung von Bedeutung. Auch für die medizinische und pharmazeutische Forschung liefert sie wichtige Erkenntnisse bei der Entwicklung neuer Medikamente. Da die RNR immer dann gebraucht wird, wenn die Zelle sich teilt oder wenn DNA-Schäden repariert werden müssen, ist das Protein Gegenstand zahlreicher Untersuchungen für die Entwicklung von Medikamenten gegen Krebs. Von einem verbesserten Verständnis der Funktionsweise und Struktur des Proteins könnte zukünftig auch die medizinische und pharmazeutische Forschung bei der Weiterentwicklung dieser Krebsmedikamente profitieren.
Originalveröffentlichung: Vasyl P. Denysenkov, Daniele Biglino, Wolfgang Lubitz, Thomas. F. Prisner, and Marina Bennati; "Structure of the Tyrosyl Biradical in Mouse R2 Ribonucleotide Reductase from High-Field PELDOR."; Angew. Chem. Int. Ed., 47: 1224-1227 (2008).
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!