Transportmechanismus von Schlüsselproteinen in der Immunantwort aufgeklärt
Sebastian Springer, Professor für Biochemie und Zellbiologie der Jacobs University Bremen, konnte in Zusammenarbeit mit Forschern der Royal Holloway University of London erstmals zeigen, wie der Transport von Schlüsselproteinen der Immunantwort an ihren Wirkort an der Zelloberfläche reguliert wird. Die Ergebnisse sind im Journal of Biological Chemistry veröffentlicht.
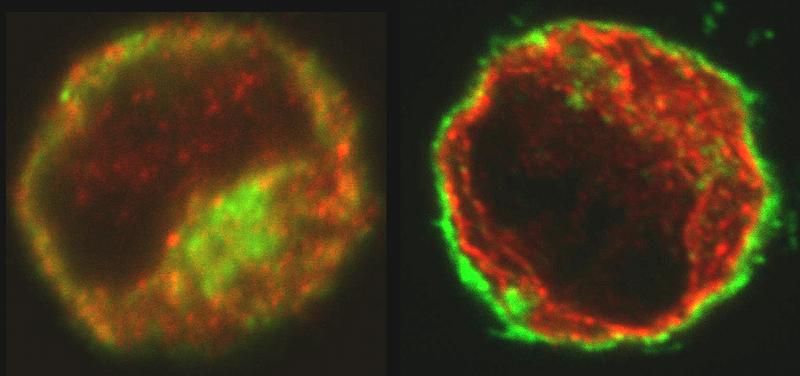
Lymphozyten im fluoreszenzmikroskopischen Bild (Durchmesser ca. 10µm): Links: MHC-Klasse-I-Moleküle (grün) ohne Peptide sind sowohl innerhalb als auch außerhalb des Endoplasmatischen Retikulums (ER, rot) zu finden. Rechts: MHC-Klasse-I-Moleküle (grün) mit Peptid-Beladung finden sich ausschließlich an der Zelloberfläche und außerhalb der ER (rot).
Jacobs University
Um eine Virusinfektion erfolgreich zu bekämpfen, muss das menschliche Immunsystem infizierte Zellen aufspüren. Im Allgemeinen vermehren sich Viren aber im Zellinneren und sind so vor den im Blut zirkulierenden Antikörpern und den Immunzellen, den Lymphozyten, verborgen. Das Aufspüren der verborgenen Viren ist die Aufgabe von Transportproteinen, sogenannten MHC (Major Histocompatibility Complex oder Haupt-histokompatibilitätskomplex)-Klasse-I-Molekülen: Sie bringen Proteinfragmente (Peptide) aus dem Zellinneren an die Oberfläche, wo sie dann von den Lymphozyten als Virenbestandteile erkannt werden können; die virusinfizierte Zelle wird dann beseitigt. Bislang ungelöst war die Frage, wie der Transport der MHC-Klasse-I-Moleküle an die Zelloberfläche reguliert wird und wie der Transport ausgelöst wird, wenn die Transportmoleküle "Abfall-Peptide" aufgenommen haben.
Sebastian Springer und seine Arbeitsgruppe an der Jacobs University zusammen mit Rainer Duden von der Royal Holloway University London konnten nun zeigen, dass die MHC-Klasse-I-Moleküle durch einen Mechanismus reguliert werden, wie er auch z.B. den Transport von Hormonen oder Zelloberflächenrezeptoren aus dem Zellinneren steuert: Die MHC-Klasse-I-Moleküle verlassen in Transportbläschen, den Vesikeln, den Ort ihrer Entstehung innerhalb der Zelle, das Endoplasmatische Retikulum (ER). Unabhängig von ihrem Beladungszustand mit Peptiden werden sie zunächst an eine Zwischenstation, den Golgi-Apparat, transportiert, wo sie einer "Qualitätskontrolle" unterworfen werden. Fehlt ein gebundenes Peptidfragment und dem MHC-Klasse-I-Molekül daher die strukturelle Festigkeit, so werden sie wieder zurück ins ER geschickt und bei der nächsten Runde aufs Neue überprüft. Erst mit fest gebundenem Peptid können sie den Weg an die Zelloberfläche antreten. Die gängige Lehrmeinung war bisher, dass MHC-Klasse-I-Moleküle das ER gar nicht verlassen können, bis sie Peptide gebunden haben, weshalb die Kontrolle ihres Beladungszustandes bislang völlig unverstanden war.
Für ihre Untersuchungen verwendeten die Wissenschaftler Zellkulturen von menschlichen und Hamster-Lymphozyten. Neben der fluoreszenzmikroskopischen Untersuchung einzelner Zellen zur Verteilung unbeladener MHC-Klasse-I-Moleküle setzten die Forscher eine neuartige Methode zur In-vitro-Isolierung von intrazellulären Transportvesikeln ein, die sie auf den Peptid-Beladungszustand der der darin enthaltenen MHC-Klasse-I-Moleküle überprüften.
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.






















































