LipoNova AG: FDA bestätigt Entwicklungsstrategie für Reniale
Der Weg zur US-Marktzulassung von LipoNova's erstem Produktkandidaten ist aufgezeigt.
Die LipoNova AG hat von der amerikanischen Food and Drug Administration (FDA) in einem Beratungsgespräch (Pre-IND-Meeting) positive Rückmeldung zum geplanten Entwicklungsprogramm des Produktkandidaten Reniale erhalten. Dieses Programm beinhaltet auch eine internationale Phase-III-Studie, vor deren Start die LipoNova AG sich das Einverständnis der wesentlichen US- und europäischen Behörden einholt.
LipoNova plant die IND (= Genehmigungsantrag) für die Phase III Studie im ersten Halbjahr 2008 einzureichen. Reniale soll so bereits sehr bald für klinische Versuchszwecke zur Verfügung stehen.
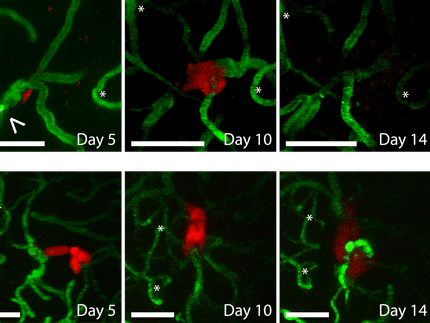
Die LipoNova AG konnte bereits in Deutschland eine nationale Phase-III-Studie abschließen, welche die positiven Therapieergebnisse von Reniale bei der adjuvanten Therapie des Nierenzellkarzinoms laut Unternehmen belegt. Einhergehend mit einem geringen Nebenwirkungsprofil verzögert Reniale den Zeitpunkt bis zum Auftreten von Metastasen laut Studie wesentlich.
Meistgelesene News
Weitere News aus dem Ressort Forschung & Entwicklung

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Kontakt und Kalzium: Pharmakologen der Uni Graz entdeckten neuen Weg zur Steuerung des Zellwachstums

Zelluläres Kraftwerk recycelt Industrie-Abgase - Die Idee ist, die Kraft von Bakterien zu nutzen, um schädliche Abgase in wertvolle Verbindungen wie Acetat oder Ethanol zu verwandeln
Daval International erhält Orphan-Drug-Status für die Behandlung von Motorneuronenerkrankungen zugesprochen