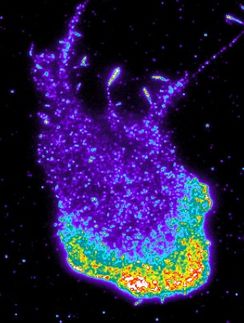
Geschickt verpackt
Wissenschaftler des Max-Planck-Instituts für Polymerforschung simulieren, wie Zellen Membranhüllen produzieren
Auf die Verpackung kommt es an: Auch Zellen schließen Proteine zum Transport in kleine Membranbläschen ein, damit sich diese unterwegs nicht mit anderen Substanzen vermischen. Wie diese Bläschen, die Vesikel, genau gebildet werden, zählt zu den wichtigen Fragen der Zellbiologie.
Forscher des Mainzer Max-Planck-Instituts für Polymerforschung haben mittels einer Computersimulation herausgefunden, wie bestimmte Proteine ohne direkte Wechselwirkung untereinander großflächige Ausstülpungen der Membran erzeugen. Der physikalische Mechanismus, den die Wissenschaftler mit ihrer Simulation entdeckten, wirkt möglicherweise auch an anderen Prozessen mit, bei denen Zellmembranen verformt werden. So ließe sich damit etwa die Bildung von Organellen mit stark gekrümmten Oberflächen wie dem Golgi-Apparat und den Mitochondrien beschreiben.
Jede Zelle des menschlichen Körpers ähnelt einer Fabrik auf kleinstem Raum, die unermüdlich tausende Substanzen produziert. Unter anderem müssen Botenstoffe und Zellbausteine synthetisiert und an die richtige Stelle transportiert werden. Für diesen Materialaustausch verfügen Zellen über einen raffinierte Verpackungsmechanismus: Fertige Proteine werden in kleine Bläschen eingeschlossen, die sich aus der Zellmembran abschnüren. Dazu lagern sich spezielle Proteine an der Membranwand an. Diese verformen die Membran - eine Einstülpung entsteht. Im Inneren eines solchen Vesikels eingeschlossene Proteine überstehen den Transport durch die Zelle, ohne sich unterwegs mit anderen Substanzen zu vermischen. Während Zellbiologen die für die Verformung zuständigen Proteine schon seit längerem kennen, wussten sie über den Prozess der Vesikelbildung bisher noch sehr wenig.
Mit einer Computersimulation haben Wissenschaftler um Markus Deserno am Max-Planck-Institut für Polymerforschung in Mainz nun gezeigt, wie Proteine bei der Verformung der Membran zusammenarbeiten: Binden sie an die Membranoberfläche, rufen sie in ihrer unmittelbaren Umgebung eine trichterähnliche Verformung hervor. Ohne direkt miteinander zu wechselwirken, beeinflussen sich die membrangebundenen Proteine indirekt über die Verformung der Membran. Sobald sich zwei Proteine zu nahe kommen und die gekrümmten Membranen überlappen, führt das zu einer Anziehung, aus der bei ausreichend vielen Proteinen eine Membraneinstülpung entsteht. Diese Anordnung der Proteine ähnelt der von zwei nah beieinander liegenden Kugeln auf einem gespannten Gummituch.
"Uns geht es dabei grundsätzlich um die Frage, wie Membranen verformt werden", sagt Markus Deserno. "In der Zelle gibt es zahlreiche Organellen, etwa den Golgi-Apparat oder die Mitochondrien, deren Membranoberflächen auf ganz bestimmte Art und Weise gekrümmt sind. Solche Verformungen kosten viel Energie, und das muss die Zelle irgendwie steuern. Möglicherweise spielen die Mechanismen, die wir entdeckt haben, auch dort eine Rolle."
Zu Beginn der Simulation sind die membrankrümmenden Proteine erst einmal gleichmäßig verteilt. Im Verlauf der Vesikelbildung wandern sie auf der Membran und häufen sich an bestimmten Stellen. "Das ist das einfachste Szenario, von dem wir ausgehen können", sagt Deserno. "Vermutlich macht die Natur das schlauer und bringt Proteine von Anfang gehäuft an bestimmte Stellen." Außerdem mussten die Max-Planck-Forscher auf die Modellierung von einzelnen Atomen verzichten, sonst wäre das Experiment im Computer rechnerisch nicht zu bewältigen gewesen. Denn während die Natur eine Vesikel in wenigen Millisekunden bildet, benötigten die Computercluster des DEISA-Projektes (Distributed European Infrastructure for Supercomputing Applications) dafür mehrere Wochen.
Originalveröffentlichung: Benedict J. Reynwar, Gregoria Illya, Vagelis A. Harmandaris, Martin M. Müller, Kurt Kremer und Markus Deserno; "Aggregation and Vesiculation of membrane proteins by curvature mediated interactionsAggregation and Vesiculation of membrane proteins by curvature mediated interactions"; Nature 2007.
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Polyethersulfone Ultrafilter von Sartorius
Zuverlässige Filtration mit PESU-Membranen
Perfekt für Biotechnologie und Pharma, widersteht Sterilisation und hohen Temperaturen

Hydrosart® Microfilter von Sartorius
Hydrophile Mikrofilter für Bioprozesse
Minimale Proteinadsorption und hohe Durchflussraten

Sartopore® Platinum von Sartorius
Effiziente Filtration mit minimaler Proteinadsorption
Reduziert Spülvolumen um 95 % und bietet 1 m² Filtrationsfläche pro 10"

Hydrosart® Ultrafilter von Sartorius
Effiziente Ultrafiltration für Biotech und Pharma
Maximale Durchflussraten und minimaler Proteinverlust mit Hydrosart®-Membranen

Polyethersulfone Microfilter von Sartorius
Biotechnologische Filtration leicht gemacht
Hochstabile 0,1 µm PESU-Membranen für maximale Effizienz

Sartobind® Rapid A von Sartorius
Effiziente Chromatographie mit Einweg-Membranen
Steigern Sie die Produktivität und senken Sie Kosten mit schnellen Zykluszeiten

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.