Entwicklungsgenetik: Als die Zellen laufen lernten
Anzeigen
Um Krankheiten wie Parkinson, die auf Veränderungen im Gehirn beruhen, oder auch Hirntumoren zielgerichtet behandeln zu können, muss man die Komplexität des Gehirns möglichst gut verstehen und wissen, wie sie zustande kommt. Wissenschaftler um Dr. Reinhard Köster am Institut für Entwicklungsgenetik des GSF-Forschungszentrums für Umwelt und Gesundheit in Neuherberg untersuchen, wie sich zunächst einfache Nervenzell-Vorläufer zu dem dicht geknüpften, hoch organisierten Netzwerk des Gehirns zusammenfinden. Sie hoffen, dass sich die Arbeiten ihrer Biofuture-Gruppe Zebrafisch-Neuroimaging als anwendbar auf den Menschen erweisen und langfristig neue Therapien ermöglichen.
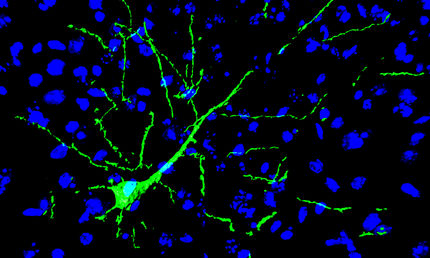
Die Entwicklungsneurobiologen der GSF kombinieren die so genannte konfokale Laserscanning-Mikroskopie mit genetisch kodierten Fluoreszenzfarbstoffen, um das Entwicklungsprogramm von entstehenden Nervenzellen direkt im Hirn mittels Zeitrafferverfahren zu verfolgen. Insbesondere interessiert sie, wie junge Nervenzellen vom Entstehungs- zum Funktionsort wandern, und welche Gene diese Wanderung steuern. Solche Prozesse zu verstehen, ist von entscheidender Bedeutung, da eine fehlerhafte Wanderung zu schweren neurologischen Defekten führt. Andererseits eröffnet die Möglichkeit, hier Einfluss zu nehmen, Ansätze für neuartige Therapien: Man könnte neuronale Stammzellen in schadhafte Hirnregionen lenken und so Nervenzellen ersetzen, die etwa durch Parkinson oder Schlaganfall verloren gegangen sind.
Ideale Objekte für die hoch auflösenden mikroskopischen Verfahren sind Embryonen von Zebrafischen: Zebrafische sind Wirbeltiere wie der Mensch, ihre Embryonen wachsen in Eiern außerhalb des Mutterleibs heran und sind transparent. Überdies entwickeln sie sich sehr rasch, so dass Filmaufnahmen von nur wenigen Tagen ausreichen, sämtliche Prozesse der Hirnentwicklung zu verfolgen, die sich beim Menschen über ein Jahr hinziehen.
Die GSF-Forscher konzentrieren sich auf wandernde Nervenzellen im Kleinhirn. Weil er das Kleinhirn sich im Laufe der Evolution nur wenig verändert hat, besteht die Hoffnung, dass sich am Zebrafisch gewonnene Ergebnisse auf den Menschen übertragen lassen. Mit mikroskopischen Zeitrafferaufnahmen konnten die Wissenschaftler die Pfade aufklären, auf denen sich die Nervenzellen bewegen. Dabei zeigt sich, dass in derselben Region entstandene Zellen sehr unterschiedliche Wanderrichtungen und damit Entwicklungsschicksale nehmen können, vermutlich abhängig vom Zeitpunkt ihrer Geburt.
Der Pfad der meisten Zellen lässt sich in mehrere Teilstrecken unterteilen. Nervenzellvorläufer, die in der Region der "Rautenlippe" entstehen, verlassen diese in Richtung Mittelhirn und wandern in einer ersten Phase bis zur Grenze zwischen Mittel- und Hinterhirn. Dort angekommen, ändern sie ihre Richtung und wandern in der folgenden zweiten Phase an dieser Grenze entlang. Haben sie den Hirnstamm erreicht, kommen sie zur Ruhe und reifen zu voll ausgebildeten Nervenzellen heran. Auch ihre Fähigkeiten und das Verhalten sind in beiden Phasen unterschiedlich: Während sich die Zellen in der ersten Phase noch teilen, um weitere Vorläufer von Nervenzellen zu bilden, sind sie in der zweiten Phase dazu offenbar nicht mehr fähig. Stattdessen beginnen sie einen langen Fortsatz auszubilden, der sie später mit Nervenzellen in anderen Hirnregionen verknüpft.
Momentan interessieren sich die Wissenschaftler vor allem für die genetischen Wechselwirkungen während der ersten Phase, die die Reifung der Nervenzellen steuern. Ein erstes Kandidatengen haben sie bereits isoliert. Außerdem legen sie besonderes Augenmerk auf die molekularen Vorgänge, die den Eintritt in die zweite Phase auslösen. Erste Analysen ergaben, dass der Übergang von Phase 1 zu Phase 2 über die Gene für einen Liganden und den dazu passenden Rezeptor gesteuert werden könnte. Das für den Liganden kodierende Gen ist im Zielgebiet der Zellen im Hirnstamm aktiv, das Gen für den Rezeptor in den wandernden Zellen. Dieses wird jedoch erst dann aktiviert, wenn die Zellen die Grenze zwischen Mittel- und Hinterhirn erreicht haben. Erst von diesem Zeitpunkt an sind sie in der Lage, den Liganden zu erkennen und auf ihn zu reagieren. Möglicherweise bedingt diese zeitliche Regulation den Richtungswechsel zwischen beiden Phasen.
Der Übergang von Phase 1 zu Phase 2 könnte bestimmend sein dafür, wie lange eine Zelle in Phase 1 bleibt, wie oft sie sich also teilt. Eventuell führt ein zu langer Aufenthalt zur Bildung eines Tumors. Angesichts der Tatsache, dass Kleinhirntumoren aus eben diesen wandernden Nervenvorläuferzellen die häufigsten Hirntumoren bei Kindern sind, ist es um so wichtiger, das Zusammenspiel von Zellteilung und -wanderung aufzuklären. Man kann auf Möglichkeiten hoffen, eine Tumorbildung zu verhindern oder wenigstens einzuschränken. Denkbar wäre zum Beispiel, Zellen zum Übergang in die zweite Phase zu zwingen, in der sie nicht mehr teilungsfähig sind. Zukünftige genetische Experimente sollen hier Klarheit bringen. Auch für Regenerationsprozesse hat die Zellwanderung zentrale Bedeutung. Studien, in denen das Kleinhirn von Zebrafischembryonen entfernt wurde, belegen eine erstaunliche Regenerationsfähigkeit dieses Hirnteils.