Kontrollierter Stress
Max-Planck-Wissenschaftler entdecken Protein, das die Befüllung kleiner Transportbläschen in der Zelle mit Stresshormonen steuert
Eine Gruppe von Neurowissenschaftlern des Göttinger Max-Planck-Instituts für experimentelle Medizin hat einen neuartigen Mechanismus entdeckt, über den die Speicherung und Freisetzung der Stresshormone Adrenalin und Noradrenalin reguliert werden, und der ein interessantes medizinisches Target darstellen könnte.
Körperlicher oder psychischer Stress - positiver wie negativer - führt im menschlichen Körper zur Freisetzung von Stresshormonen. Die Stresshormone Adrenalin und Noradrenalin werden nach Aktivierung des vegetativen Nervensystems aus Zellen der Nebennierenrinde ausgeschüttet. Sie erhöhen Herzfrequenz und Blutdruck und mobilisieren die in Form von Fett oder Glykogen gespeicherten Energiereserven des Körpers. Auf diese Weise wird kurzfristig die Belastbarkeit und Reaktionsfähigkeit des Körpers erhöht, was in bestimmten Stresssituationen lebenswichtig sein kann.
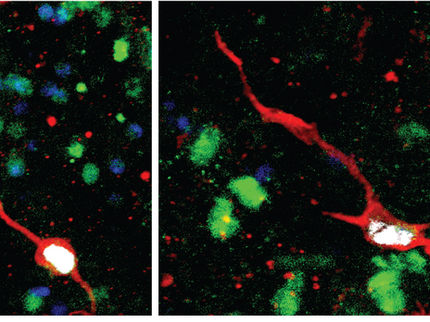
Adrenalin und Noradrenalin werden von den Zellen des Nebennierenmarks in kleinen Bläschen, so genannten chromaffinen Vesikeln, gespeichert. Diese besitzen spezielle Transportproteine, die die Aufnahme der Stresshormone und ihre Speicherung gewährleisten. Die Zellen des Nebennierenmarks sind voll von "hormonbeladenen" chromaffinen Vesikeln. Bei einer durch Stress verursachten Erregung des vegetativen Nervensystems verschmelzen die Bläschen mit der Zellmembran und geben so ihren Inhalt in den Blutstrom ab - mit den bekannten Stresseffekten.
Die Biologin Dina Speidel aus der Abteilung von Nils Brose am Max-Planck-Institut für experimentelle Medizin hat einen bisher unbekannten Mechanismus gefunden, der die Speicherung und Freisetzung von Adrenalin und Noradrenalin reguliert: Auf chromaffinen Vesikeln entdeckte Speidel ein Protein, das für die Befüllung der Transportbläschen mit Adrenalin und Noradrenalin offensichtlich unentbehrlich ist. An genetisch veränderten Mäusen konnte die Wissenschaftlerin zeigen, dass bei Abwesenheit des als CAPS1 bezeichneten Proteins nur etwa die Hälfte aller chromaffinen Vesikel Adrenalin oder Noradrenalin enthält, die übrigen aber leer sind. Das führt zu einer stark herabgesetzten Freisetzung der beiden Stresshormone und gemeinsam mit anderen Veränderungen zum Tod der Versuchstiere.
Die Göttinger Forscher, die ihre Studien gemeinsam mit den Physiologen Cathrin Brüderle und Jens Rettig von der Universität des Saarlandes (Homburg/Saar) durchgeführt haben, gehen davon aus, dass CAPS1 entweder die Aufnahme von Adrenalin und Noradrenalin in chromaffine Vesikel oder deren Speicherung regulieren. "Sollte sich wirklich herausstellen, dass CAPS1 die Aufnahme von Stresshormonen und anderen Botenstoffen in ihre Speichervesikel reguliert, wäre dieses Protein ein viel versprechendes neues Ziel für pharmakologische Verfahren, um Stressreaktionen und andere Funktionen des Nervensystems zu beeinflussen", sagt Speidel.
Originalveröffentlichung: D. Speidel, C. E. Brüderle, C. Enk, T. Voets, F. Varoqueaux, K. Reim, U. Becherer, F. Fornai, S. Ruggieri, Y. Holighaus, E. Weihe, D. Bruns, N. Brose, J. Rettig; "CAPS1 Regulates Catecholamine Loading of Large Dense-Core Vesicles"; Neuron 2005.
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Afrigen Biologics (Pty) Limited Labs - Cape Town, Südafrika
Biomoleküle einfach markiert – für die Kontrolle von Immunzell-Membranen - Neues Labeling für Peptide entwickelt
Roche investiert 430 Millionen Franken an den Standorten in Deutschland und der Schweiz - Ausbau von Forschungs- und Produktionszentren zur Entwicklung, Herstellung und Abfüllung innovativer Biopharmazeutika

MLL Münchner Leukämielabor GmbH - München, Deutschland
Mit einem künstlich zusammengesetzten Virusfragment auf dem Weg zum Chikungunya-Impfstoff?
Proteros und Hutchison MediPharma schließen langfristigen Kooperationsvertrag
Gummi aus Löwenzahn
Wenn die Luft knapp wird im Tumor...