Adulte Stammzellen sind allein unfähig, neue Blutgefäße zu bilden
Bad Nauheimer Max-Planck-Wissenschaftler revidieren Ansichten, wonach man aus Stammzellen "natürliche Bypässe" legen könnte
Adulte Stammzellen spielen nach unserer Geburt möglicherweise eine wesentlich geringere Rolle beim Wachstum von Blutgefäßen als bisher angenommen. Das ist das Ergebnis einer neuen Studie aus der Arbeitsgruppe von Prof. Wolfgang Schaper am Max-Planck-Institut für physiologische und klinische Forschung in Bad Nauheim, die jetzt in der internationalen Fachzeitschrift "Circulation Research" der American Heart Association veröffentlicht wurde (Circulation Research, Februar 2004). Die Forscher hatten bei speziellen Mauslinien untersucht, ob Knochenmarks-Stammzellen bei der Arteriogenese, einer Form des Wachstums von Arterien aus bereits vorhandenen kleinsten Blutgefäßen, tatsächlich in die Gefäßwand eingebaut werden. Dieser Wachstumsprozess setzt beispielsweise beim chronischen Verschluss einer Herzkranz-Arterie ein und kann zur Bildung eines natürlichen Gefäß-Bypasses führen, der im Idealfall Defizite in der Blutversorgung kompensieren kann. Doch entgegen den Befunden anderer Forschergruppen zeigen die Max-Planck-Wissenschaftler, dass die Stammzellen offenbar unfähig sind, während der Arteriogenese die Funktion von Zellen der Gefäßwand zu übernehmen. Es ist noch gar nicht lange her, dass gängige Vorstellungen, wonach die Vaskulogenese (Entstehung neuer Blutgefäße aus primitiven Stammzellen) auf den embryonalen Lebensabschnitt beschränkt sei, in Frage gestellt wurden. Vielmehr schlug man vor, aus dem Knochenmark kommende adulte Stammzellen würden auch noch nach der Geburt im Körper zirkulieren und in sich neu entwickelnde Blutgefäße eingebaut. Mehr noch, die Transplantation dieser Stammzellen schien bei Krankheiten wie Herzinfarkt oder Schlaganfall eine rasche Erneuerung der betroffenen Blutgefäße zu versprechen. Doch inzwischen wurden bereits in einigen Studien erste Zweifel daran laut, ob sich Knochenmarkstammzellen unter diesen Umständen tatsächlich in Organ-spezifische Zellen differenzieren könnten.
Vor diesem Hintergrund haben sich Wissenschaftler des Max-Planck-Instituts für physiologische und klinische Forschung intensiv mit der Frage beschäftigt, welche Rolle die Knochenmarkstammzellen speziell beim adaptiven Wachstum von Blutgefäßen spielen. Diese Remodellierung des arteriellen Systems, nachdem sich eine wichtige Arterie - zum Beispiel durch Arteriosklerose oder Thrombose - verschlossen hat, bezeichnet man als Arteriogenese. Von Natur aus bestehen besonders in Herz, Gehirn und Beinen zwischen den großen Arterien Verbindungen in Form kleinster Blutgefäße (Anastomosen), die bei einer Verengung bzw. einem Verschluß einer Schlagader deren Funktion, also die Blutversorgung von bestimmten Körperteilen, übernehmen können: Um den Verschluss herum bilden sich dann aus diesen bereits existierenden Netzwerken aus Mikro-Arterien durch Zellteilung und Gewebsumbau echte funktionelle Arterien, die unter günstigen Bedingungen die verschlossene Arterie vollständig ersetzen können (natürlicher Bypass).
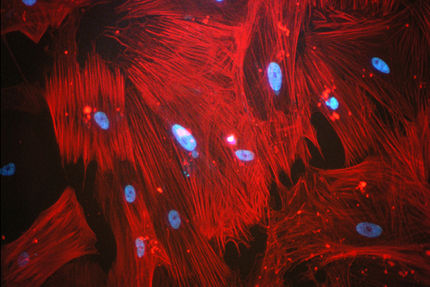
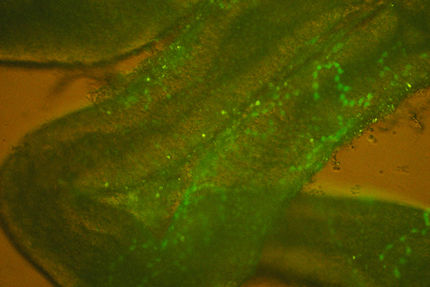
Im Zentrum der neuen Studie stehen aus dem Knochenmark mobilisierte Zellen, die frei im Blut zirkulieren. Um zu überprüfen, ob diese Stammzellen oder ihre Nachfahren in die Kollateralgefäßwand eingebaut werden, bedienten sich die Forscher des "grün fluoreszierenden Proteins" (GFP) aus Korallen. Sie transplantierten modifiziertes Knochenmark aus transgenen Mäusen, die das GFP-Protein exprimieren, in zuvor letal bestrahlte Versuchsmäuse. Anschließend wurde bei diesen Tieren die Arteriogenese durch den Verschluss der großen Oberschenkelarterie künstlich ausgelöst.
Als die Wissenschaftler das Gewebe um die Kollateralgefäße untersuchten, kamen sie zu einem überraschenden Ergebnis: Obwohl sie mehr als 3.000 Gewebsschnitten mit einem hochauflösenden konfokalen Laserscanningmikroskop analysiert hatten, fand sich nicht eine einzige (grün leuchtende) Gefäßwandzelle, die aus den im Blut zirkulierenden Stammzellen hervorgegangen wäre. Vielmehr konnten die Wissenschaftler eine Vielzahl von Leukozyten im näheren Umfeld um die Kollateralgefäßwand nachweisen, vor allem Monozyten und T-Lymphozyten. Außerdem wurden Gewebs-Stützzellen (Fibroblasten), die, wie die Leukozyten, durch ihr grünes Leuchten das Knochenmark als Ursprung verrieten, gefunden. Die Forscher schlossen daraus, daß es zwar nicht zu einer Integration von Stammzellen in das wachsende Gefäß kommt, sondern vielmehr zu einer Ansammlung von aus dem Knochenmark stammenden Zellen, offenbar, um das Gefäßwachstum zu stimulieren, statt selbst darin eingebaut zu werden.
Diese Ergebnisse widersprechen Studien anderer Arbeitsgruppen, in denen der Einbau von Stammzellen in die Gefäßwand und die Übernahme von Funktion und Morphologie der Wandzellen vorgeschlagen wurde. Die Differenz in den Befunden führen die Bad Nauheimer Wissenschaftler auf die von ihnen erreichte wesentlich höhere Auflösung der mikroskopischen Untersuchungen zurück. So konnten sie erstmals zeigen, dass es sich bei Endothelzellen, die vermeintlich sowohl Stammzell- als auch Endothelmarker exprimierten, bei näherer Betrachtung nur um zwei eng benachbarte Zellen handelte.
Bereits in früheren Studien hatten die Bad Nauheimer Max-Planck-Forscher wesentliche neue Ergebnisse zur Arteriogenese vorgelegt: So konnten sie nachweisen, dass der wichtigste physikalische Stimulus für das Gefäßwachstum die Schubspannung ist, die das fließende Blut auf die innere Auskleidung (Endothel) des Blutgefäßes ausübt. Dieses mechanische Signal wird über eine intrazelluläre Signalkaskade umgesetzt, die bestimmte Transkriptionsfaktoren anschaltet (z.B. egr-1 und carp). Diese Faktoren wiederum lösen die Expression von Proteinen auf der Oberfläche der Endothelzellen aus, mit deren Hilfe bestimmte Leukozyten, die so genannten Monozyten, aus dem vorbeiströmenden Blut angelockt werden.
Auch über die Funktion der Monozyten haben die Wissenschaftler wichtige neue Erkenntnisse gewonnen: Es zeigte sich, dass diese Zellen als eine Art "Fabrik" für wachstumsstimulierende Faktoren fungieren. Diese Wachstumsfaktoren stimulieren die Teilung und Aktivierung von Zellen der Gefäßwand, wodurch die betroffene Arteriole um das bis zu 20-fache ihres ursprünglichen Durchmessers zunehmen kann. So identifizierten die Wissenschaftler eine Reihe von Proteinen wie VEGF, bFGF und MCP-1, von denen schon länger bekannt ist, dass sie das Wachstum von Blutgefäßen fördern bzw. an damit im Zusammenhang stehenden Entzündungsreaktionen beteiligt sind. Einige dieser Faktoren, die Monozyten anlocken, haben die Bad Nauheimer Forscher bereits patentieren lassen. Eine der gefundenen Substanzen wurde in klinischen Studien bereits erfolgreich untersucht und war wirksam bei Durchblutungsstörungen des Herzmuskels. Im Tierversuch war diese Substanz imstande, einen Schlaganfall auch noch nach Verschluss von drei der vier Hirnarterien zu verhindern. Ein anderer von den Forschern patentierter Faktor ist in den USA und in Amsterdam derzeit in der klinischen Prüfung für periphere Durchblutungsstörungen.
Die Wissenschaftler um Prof. Schaper schließen aus ihren Experimenten, dass therapeutische Ansätze - zum Beispiel zur Vorbeugung und Behandlung von Herzinfarkt oder Schlaganfall - besonders erfolgsversprechend sein könnten, wenn es gelänge, die Mobilisierung von Zellen aus dem Knochenmark zu dem Zeitpunkt zu stimulieren, wenn ihre Unterstützung beim Wachstum der Kollateralarterien am wirkungsvollsten wäre. "Die Förderung der Arteriogenese könnte in Zukunft ein wichtiges Behandlungsprinzip, zum Beispiel in der Herzmedizin, werden. Allerdings scheint jetzt klar, dass Knochenmarksstammzellen hierbei nicht direkt als Ersatzteile eingebaut werden, sondern lediglich die verstärkte Teilung der Gefäßzellen anregen," so Prof. Schaper selbst. Bisher wird bei Patienten die Gefäßverengung entweder mittels eines Ballon-Katheters erweitert oder durch einen chirurgisch angelegten Bypass überbrückt.
Die Studie wurde unterstützt durch die Max-Planck-Gesellschaft sowie die Kerckhoff-Klinik in Bad Nauheim.