Kleine Moleküle kommen groß raus - Wissenschaftliches Glanzlicht des Jahres 2002
Max-Planck-Forscher erhalten für die Entdeckung, dass kleine RNA-Moleküle gezielt die Aktivität von Genen regulieren, den internationalen "Newcomb Cleveland-Preis"
Anzeigen
Für die Entdeckung der kleinen RNA-Moleküle, das "biologische Äquivalent der schwarzen Materie, allgegenwärtig, doch schwer zu greifen", haben die Autoren von drei in der Zeitschrift Science veröffentlichten Artikeln - darunter der Leiter der Forschungsgruppe "Kombinatorische Biochemie", Dr. Thomas Tuschl, und seine Mitarbeiter vom Max-Planck-Institut für biophysikalische Chemie in Göttingen - den "Newcomb Cleveland-Preis 2001/2002" erhalten. Mit dem nach seinem Stifter Newcomb Cleveland aus New York City benannten Preis, würdigt die American Association for the Advancement of Science (AAAS) seit 1923 wegweisende Artikel und Berichte in der internationalen Fachzeitschrift Science. Die Forscher förderten eine bisher unbekannte Steuerungsebene der Gene zu Tage, die nach Meinung vieler Wissenschaftler nicht nur an zahlreichen Krankheitsprozessen wie Krebs beteiligt ist, sondern möglicherweise auch erklären kann, wie aus einer nahezu gleichen Anzahl von Genen so unterschiedliche Organismen wie beispielsweise der Mensch oder die Maus hervorgehen können.
Noch vor kurzem war man davon überzeugt, die Rolle der wichtigsten Akteure in der Zelle verstanden zu haben. Doch eine Reihe Aufsehen erregender Artikel, die im vergangenen Jahr in Science publiziert wurden, wirft jetzt ein ganz neues Licht auf die bisher gängige Lehrmeinung. Drei Forscherteams von der Dartmouth Medical School in Hanover, New Hampshire, vom Whitehead Institute for Biomedical Research und dem Massachusetts Institute of Technology in Cambridge, Massachusetts, sowie vom Max-Planck-Institut für biophysikalische Chemie in Göttingen haben gemeinsam "die völlig unerwartete Vielfalt von ultrakleinen RNA-Molekülen aufgedeckt", erklärte Donald Kennedy, Editor-in-Chief von Science. "Wir haben gelernt, dass diese allgegenwärtigen RNA-Moleküle über die Evolution in einer Vielzahl von Organismen konserviert wurden und an der Regulation der Gene für die Entwicklung von Zelltypen und Geweben beteiligt sind. Mit den herausragenden Beiträgen der drei Forschergruppen wurde ein neues Kapitel in unserem Verständnis der Genkontrolle aufgeschlagen."
Über Jahrzehnte hinweg wurden die RNA-Moleküle in erster Linie als willige "Befehlsempfänger" betrachtet, die quasi Anweisungen von der DNA entgegen nehmen und dazu beitragen, die genetische Information in Proteine umzuwandeln. Das wissenschaftliche Augenmerk richtete sich auf die eher langen Stränge der Boten-RNA (mRNA), die die genetische Information aus dem Zellkern zu den Ribosomen, den Proteinfabriken der Zelle, transportieren und dort helfen, die Aminosäurebausteine in der richtigen Reihenfolge zusammenzusetzen. Eine Reihe neuer Studien hat jetzt jedoch gezeigt, welches Potenzial in den kleinen RNA-Molekülen, den so genannten microRNAs (miRNA) sowie den small interfering RNAs (siRNA) steckt - sie sind nämlich maßgeblich an der Steuerung wichtiger Prozesse in der Zelle beteiligt.
Die aus maximal 21 bis 23 Nukleotiden bestehenden Molekül-Schnipsel können nicht nur einzelne Gene ausschalten bzw. die Intensität ihrer Expression verändern; sie bauen, wie die Forscher inzwischen für einige Organismen herausgefunden haben, auch ganze Genome um, indem sie weiterhin benötigte Informationsabschnitte herausschneiden und andere verwerfen. Darüber hinaus gibt es Hinweise, dass manche der kleinen RNA-Moleküle sogar über die weitere Bestimmung der Zellen mitentscheiden: Durch das An- und Abschalten einzelner Gene während der Zellentwicklung weisen sie eine Zelle zu einem bestimmten Zeitpunkt einem spezifischen Gewebetyp zu und können außerdem festlegen, wie lange diese Zelle ihre Fähigkeit zur Zellteilung beibehält.
Seit 1990 gab es Hinweise dafür, dass RNA-Moleküle unter Umständen eine wesentlich komplexere Rolle im Zellgeschehen übernehmen als bisher angenommen. Damals entdeckten Biologen erstmals, dass einige kleine "RNA-Schnipsel" die Expression verschiedener Gene in Pflanzen- und Tierzellen unterdrücken können. Welches Potenzial tatsächlich in diesen kleinen Molekülen steckt, wurde jedoch erst 1998 deutlich, als es mehreren Gruppen gelang zu zeigen, dass sich Gene durch doppelsträngige RNA blockieren lassen. Dabei zerlegen die kleinen doppelsträngigen RNA-Moleküle die Boten-RNA und regeln somit die Gen-Expression, also die Übersetzung der DNA-Sequenz in die entsprechende Aminosäuresequenz des Proteins - ein Phänomen, was seither als RNA-Interferenz (RNAi) bekannt ist. Dies waren die ersten Belege dafür, dass RNA-Moleküle grundsätzlich etwas mit dem Ein- und Ausschalten von Genen in der Zelle zu tun haben könnten. Im Sommer 2001 kam die Entdeckung eines Enzyms hinzu, das die Forscher dann treffend "Dicer", also Häcksler nannten; es erzeugt durch das Zerschneiden doppelsträngiger RNA die extrem kurzen RNA-Moleküle. An der weiteren Untersuchung dieser Proteine, die als wichtige Rädchen in der RNAi-Maschinerie fungieren, setzen auch neuere Forschungsarbeiten an.
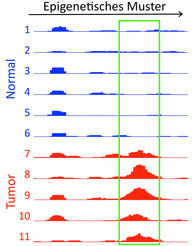
Im Herbst 2001 häuften sich die aufregenden Befunde: Mehrere Forschergruppen hatten untersucht, auf welche Weise die RNA-Interferenz dazu beiträgt, ein merkwürdiges und doch allgegenwärtiges genetisches Phänomen, die Epigenetik, zu steuern. Die Epigenetik ist eine Steuerungsebene oberhalb der Gene (daher der Begriff "epi" für "oberhalb"). Durch reversible, also wieder rückgängig machbare Veränderungen wird der Zugriff auf bestimmte genetische Abschnitte reguliert; der DNA-Code selbst bleibt dabei unangetastet. Die Veränderungen können über maximal eine Generation fortbestehen. Eine Art der epigenetischen Regulierung, das haben Forscher herausgefunden, wird durch Veränderungen des Chromatin-Komplexes verursacht. Dabei wird die DNA quasi wie ein Faden um bestimmte Proteine (Histone) herumgewickelt und bildet so die Chromosomen. Um bestimmte Gene ablesen zu können, muss der DNA-Faden in dem entsprechenden Bereich zugänglich gemacht werden - und das geschieht durch Formveränderungen des Chromatin-Komplexes. Was diese Formveränderung antreibt, war bisher jedoch unbekannt. Bereits vor zwei Jahren fanden die drei genannten amerikanischen Forschergruppen heraus, dass die kleinen RNAs eine wirksame Kontrolle darüber ausüben, welche äußere Gestalt das Chromatin annimmt.
Die Biochemiker vom Max-Planck-Institut für biophysikalische Chemie in Göttingen - Mariana Lagos-Quintana, Reinhard Rauhut, Winfried Lendeckel und Thomas Tuschl - konnten nun zeigen, dass die kleinen RNA-Moleküle nicht nur in Wirbellosen, sondern auch in Wirbeltieren vorkommen. Offensichtlich nehmen diese Moleküle also ganz grundlegende Regulierungsfunktionen in der Zelle wahr. Darüber hinaus gelang der Gruppe der Nachweis, dass miRNA-Moleküle eine wichtige Rolle bei der Regulierung der Entwicklungszeit und der Gewebespezifität von Zellen spielen.
In einem im Mai 2001 in der Zeitschrift Nature veröffentlichten Artikel hatte Thomas Tuschl erstmals zeigen können, dass die RNA-Interferenz mit kleinen RNA-Molekülen auch in Säugetierzellen funktioniert (vgl. PRI B 15/2001 (33) "Methodischer Durchbruch in der Gentechnologie"). Damit halten die Wissenschaftler ein ideales Werkzeug für die funktionelle Genomanalyse in Händen, welches langfristig vollkommen neue Möglichkeiten für die Gentherapie eröffnen könnte. An die RNA-Interferenz knüpfen sich vielfältige Erwartungen: So sind die Forscher dabei, mit Hilfe der Bioinformatik und Genetik die Funktionen zu katalogisieren, welche die inzwischen bekannten mehr als einhundert verschiedenen RNA-Moleküle haben, und festzuhalten, in welchen Spezies und Geweben sie zu welchem Zeitpunkt vorkommen. Zudem gibt es Hinweise, dass die RNA-Moleküle in Pflanzen und Tieren unterschiedliche Aufgaben übernehmen. "Ein tieferes Verständnis der Expression und Aktivität von kleinen RNA-Molekülen könnte zur Entwicklung neuer Methoden führen, mit deren Hilfe man ganz spezifische Gene regulieren kann", sagt Thomas Tuschl. "Angesichts der hohen Spezifität der siRNA sollte es eigentlich möglich sein, auch krankmachende mRNA-Transkripte (Abschriften), wie beispielsweise das krebsverursachende ras, mit Punkt-Mutationen auszuschalten, ohne die anderen Allele zu verändern. Schließlich könnte diese Methode eine kosteneffiziente Alternative für eine automatisierte, das gesamte Genom erfassende Phänotyp-Analyse sein."
Unter Nutzung der Ergebnisse von Tuschl ist es Forschern Mitte 2002 bereits gelungen, die HIV-Ausbreitung in Zellkulturen zu stoppen. Dabei werden Gene im Virus selbst sowie in den Kulturzellen mit Hilfe der RNA-Interferenz ausgeschaltet und so die Produktion wichtiger Proteine verhindert. Für Tuschl ist das erst der Anfang einer ganzen Welle von Studien, in denen kleine RNA-Moleküle benutzt werden, um Virusinfektionen zu verhindern. Noch befinden sich die kleinen RNA-Moleküle im Stadium der Grundlagenforschung, doch bereits jetzt kann diese Technik als potenzielle Therapie überprüft werden. Andere Forschergruppen arbeiten daran, Zellen durch die intrazelluläre Produktion von RNA-Molekülen resistent gegen den Angriff des Virus zu machen bzw. unfähig, das Virus zu übertragen.
Für seine richtungsweisenden Arbeiten zur Erforschung kleiner RNA-Moleküle hatte Thomas Tuschl bereits im November 2002 den mit 25.000 Euro dotierten Otto-Klung-Weberbank-Preis erhalten. Dieser Preis wird jährlich im Wechsel für Chemie oder Physik von der Otto-Klung-Stiftung der Freien Universität Berlin und der Fördergesellschaft Weberbank gGmbH vergeben.
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Gentherapie
Genetische Erkrankungen, die einst als unbehandelbar galten, stehen nun im Zentrum innovativer therapeutischer Ansätze. Die Forschung und Entwicklung von Gentherapien in Biotech und Pharma zielen darauf ab, defekte oder fehlende Gene direkt zu korrigieren oder zu ersetzen, um Krankheiten auf molekularer Ebene zu bekämpfen. Dieser revolutionäre Ansatz verspricht nicht nur die Behandlung von Symptomen, sondern die Beseitigung der Krankheitsursache selbst.

Themenwelt Gentherapie
Genetische Erkrankungen, die einst als unbehandelbar galten, stehen nun im Zentrum innovativer therapeutischer Ansätze. Die Forschung und Entwicklung von Gentherapien in Biotech und Pharma zielen darauf ab, defekte oder fehlende Gene direkt zu korrigieren oder zu ersetzen, um Krankheiten auf molekularer Ebene zu bekämpfen. Dieser revolutionäre Ansatz verspricht nicht nur die Behandlung von Symptomen, sondern die Beseitigung der Krankheitsursache selbst.