Neuer Wirkstoff steigert Wirkung konventioneller Antibiotika erheblich
Antibakterielles β-Lakton infiltriert Mykomembran-Biosynthese und tötet Tuberkulose-Erreger
Tuberkulose ist eine der am weitesten verbreiteten, lebensgefährlichen Infektionskrankheiten. Nicht nur Antibiotika-Resistenzen bereiten bei der Behandlung Schwierigkeiten, sondern auch die nur wenig durchlässige Mykomembran der Erreger, die die Wirksamkeit vieler Pharmaka einschränkt. Auf der Suche nach neuartigen Antibiotika haben Forscher ein Strukturanalogon von Mykolsäuren, den essentiellen Membranbausteinen, entwickelt. Wie sie in der Zeitschrift Angewandte Chemie berichten, hemmt dieser Wirkstoff Schlüsselenzyme der Mykomembran-Biosynthese und steigert die Wirkung konventioneller Antibiotika ganz erheblich.
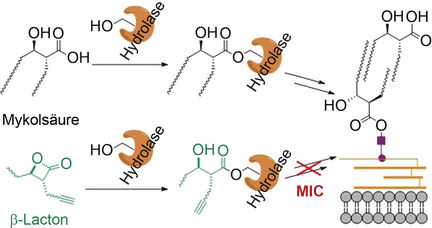
Neuer Wirkstoff steigert Wirkung konventioneller Antibiotika erheblich.
© Wiley-VCH
Bei der Mykomembran des Tuberkulose-Erregers, Mycobacterium tuberculosis, handelt es sich um eine Lipid-Doppelschicht, die eine äußere Barriere bildet. Entscheidende Bausteine sind Mykolsäuren, verzweigte β-Hydroxy-Fettsäuren mit zwei langen Kohlenwasserstoffketten. Während der Biosynthese und der Einbettung der Mykolsäuren in die Mykomembran spielen eine Reihe enzymatischer Schritte eine entscheidende Rolle, bei denen die Mykolsäuremoleküle mit Esterbindungen an Seringruppen verschiedener Enzyme gebunden vorliegen.
Wissenschaftler um Stephan A. Sieber und Eric J. Rubin vermuteten, dass Verbindungen, die sich als Mykolsäure „tarnen“, ebenfalls an diese Enzyme binden, diese blockieren und so die Biosynthese der Mykomembranen „infiltrieren“ könnten. Ihre Wahl fiel auf die Gruppe der β-Laktone, gespannte Vierringe mit einer internen Esterbindung. Bei einer Ringöffnung entsteht eine Struktur, die dem Molekülteil der Mykolsäuren entspricht, der an die Enzyme bindet. Das Team von der Technischen Universität München, der Harvard T.H. Chan School of Public Health, der Harvard Medical School und der Texas A&M University (alle USA) testete eine breite Palette verschiedener β-Laktone auf anti-mykobakterielle Aktivität und konnten einen Volltreffer landen: Verbindung „EZ120“ hemmt die Biosynthese der Mykomembran und tötet Mykobakterien ab.
Durch Enzymtests und massenspektrometrische Untersuchungen unter Zusatz spezieller 13C-markierter Substrate (Metaboliten-Profiling) konnten die Wissenschaftler zeigen, dass der neue Inhibitor vor allem die Enzyme Pks13 und Ag85 blockiert. Pks13 ist eine Polyketidsynthase, die die beiden Ketten der Mykolsäuren zu einem Molekül verknüpft. Ag85 ist eine Gruppe von Serin-Hydrolasen, die eine entscheidende Rolle beim Einfügen der Mykolsäure in die Mykomembran spielen.
EZ120 wirkt bereits in geringer Dosis, kann hervorragend in Tuberkulosezellen eindringen und zeigt nur eine geringe Toxizität gegenüber humanen Zellen. Eine gemeinsame Verabreichung mit dem bereits zugelassenen Antibiotikum Vancomycin steigert die Wirksamkeit beider Einzelsubstanzen erheblich. So ist EZ120 in der Kombination mit Vancomycin etwa 100-mal wirksamer – vermutlich weil es durch die Schwächung der Mykomembran leichter in die Bakterien eindringen kann. Dies, und die Tatsache, dass mehrere zelluläre Ziele erfasst werden, könnte ein Ansatzpunkt für neuartige Tuberkulose-Therapien sein.
Originalveröffentlichung
Lehmann, J., Cheng, T.-Y., Aggarwal, A., Park, A. S., Zeiler, E., Raju, R. M., Akopian, T., Kandror, O., Sacchettini, J. C., Moody, D. B., Rubin, E. J. and Sieber, S. A.; "Ein antibakterielles β-Lacton bekämpft Mycobacterium tuberculosis durch Infiltration der Mykolsäurebiosynthese"; Angew. Chem.; 2017.
Meistgelesene News
Originalveröffentlichung
Lehmann, J., Cheng, T.-Y., Aggarwal, A., Park, A. S., Zeiler, E., Raju, R. M., Akopian, T., Kandror, O., Sacchettini, J. C., Moody, D. B., Rubin, E. J. and Sieber, S. A.; "Ein antibakterielles β-Lacton bekämpft Mycobacterium tuberculosis durch Infiltration der Mykolsäurebiosynthese"; Angew. Chem.; 2017.
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.