Darmkeime entwaffnen statt töten
Forscher entdecken neuen Wirkstoff, um Clostridien unschädlich zu machen
Clostridien sind Bakterien, die weltweit in der Umwelt oder im Darm gesunder Menschen und Tiere vorkommen. Sie können allerdings gefährlich werden, da sie Giftstoffe ausscheiden, die zu schweren Erkrankungen wie Tetanus oder Gasbrand führen können. Ein wichtiger Angriffspunkt, um die Erreger zu bekämpfen, ist das bakterielle Enzym Kollagenase. Mithilfe dieses Enzyms können sich Clostridien durch den Abbau von Kollagen im Bindegewebe des Wirtes besonders rasch ausbreiten. Forscher des Helmholtz-Instituts für Pharmazeutische Forschung Saarland (HIPS) in Saarbrücken, einem Standort des Helmholtz-Zentrums für Infektionsforschung (HZI), entdeckten jetzt gemeinsam mit Wissenschaftlern der Universität Salzburg einen neuen hochselektiven Wirkstoff, der speziell diesen Virulenzfaktor der Clostridien ausschalten kann. Die neue Wirkstoffklasse wirkt äußerst selektiv auf bakterielle, nicht aber auf menschliche Zink-Proteasen. Auf Basis dieser Erkenntnisse können zukünftig innovative Anti-Infektiva entwickelt werden, die Clostridien gezielt entwaffnen.
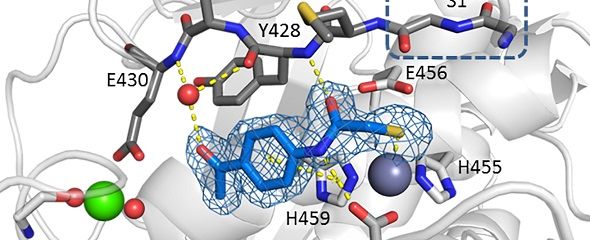
Peptidase-Domain der Kollagenase H mit Inhibitormolekül (blau).
© Schönauer, Kany et al.
Clostridien sind weit verbreitete Keime, die beispielsweise im Erdboden vorkommen. Die Stäbchen wachsen ohne Sauerstoff und bilden unter ungünstigen Umweltbedingungen Sporen aus. Der krankmachende Mechanismus von Clostridien beruht vor allem auf deren Bildung von Toxinen, also speziellen Giftstoffen der Clostridien. So kommt es bei einer Wundinfektion mit dem Erreger Clostridium tetani durch Verletzungen und Kontakt mit Erde zur Tetanuserkrankung, wobei durch das Bakterium gebildetes Tetanustoxin zu einer spastischen Lähmung der Muskulatur führen kann. Ein weiterer Vertreter ist Clostridium histolyticum, ein seltener, jedoch gleichzeitig der gefährlichste Erreger des Gasbrandes. Er ist aufgrund der neun Toxine, die er produziert, sowohl für den Menschen als auch für Tiere gefährlich. Dabei wirkt er stark gewebeauflösend, sodass er seinen Namen dieser Eigenschaft zu verdanken hat.
Umfangreiche Anstrengungen wurden schon unternommen, um die molekulare Basis dieser lebensbedrohlichen Infektionen aufzuklären, da die Bakterien auch beim Einsatz in Biowaffen eine Rolle spielen. Bisher stellten diese Infektionen noch eine der großen Herausforderungen dar, da die Forschung bisher noch nicht zu ausreichenden Therapieoptionen geführt hat. „Die hohe Sterberate bei einer Clostridien-Infektion steht in enger Verbindung mit einem bakteriellen Enzym – der sogenannten Kollagenase – welches für die hohe Virulenz der Bakterien mitverantwortlich ist“, sagt Dr. Jörg Haupenthal, Wissenschaftler am HIPS in Saarbrücken. „Das Enzym spielt eine maßgebliche Rolle, wenn das Bakterium den Wirt besiedelt, seine Immunabwehr umgeht oder Nährstoffe ansammelt.“
Das natürliche Substrat des Enzyms ist das Kollagen, eines der Hauptbestandteile der extrazellulären Matrix und des Bindegewebes von Säugetieren. Das Strukturprotein Kollagen besteht aus drei Polypeptidketten, die in einer Helix zusammengewunden und dadurch normalerweise sehr resistent gegen enzymatischen Abbau sind. „Die bakteriellen Kollagenasen haben vielfältige Möglichkeiten, das Strukturprotein zu attackieren und es in kleine Peptide zu zerlegen“, sagt Haupenthal. „Mit der Kollagenase sind die Bakterien in der Lage, das Protein zu verdauen und sich dadurch den Weg durch das Bindegewebe zu bahnen, vergleichbar mit einer Planierraupe.“ Durch die Gewebeschädigung können sich die Krankheitserreger bei einer Infektion besser verbreiten und die Gifte der Clostridien leichter diffundieren.
Die Saarbrücker Wissenschaftler setzen bei ihrer Forschungsarbeit auf die Hemmung der extrazellulären Kollagenase der Clostridien mit einem Wirkstoff. „Sich auf diese Enzyme als Ziele bei der Infektionsabwehr zu konzentrieren, bedeutet einen substanziellen Vorteil, weil der Wirkstoff die bakterielle Zellwand nicht mehr durchdringen muss, was in vielen Fällen eine große Herausforderung ist. Die Kollagenasen stellen daher ein erstklassiges Target für eine effektive Therapie gegen Clostridien und Bazilleninfektionen dar“, sagt Andreas Kany, zweiter Erstautor der Studie. „Das Pathogen wird nicht direkt attackiert, sondern nur die Besiedelung und seine Verbreitung im Wirtsgewebe blockiert. Daher ist der evolutionäre Selektionsdruck, eine Antibiotika-Resistenz zu entwickeln, vergleichsweise gering. Wir erschaffen somit weniger schädliche Bakterien.“
„Bisher waren lediglich unselektive Hemmstoffe der bakteriellen Kollagenase H bekannt“, sagt Prof. Rolf Hartmann, Leiter der HIPS-Abteilung „Wirkstoffdesign und Optimierung“. Um einen wirksamen Inhibitor entwickeln zu können, fehlten den Forschern noch hochauflösende Strukturdaten der Clostridien-Enzyme, um genau zu erkennen, wie die Kollagenase aussieht. Diese Expertise brachte eine wissenschaftliche Kooperation mit dem Team um Prof. Hans Brandstetter von der Universität Salzburg, der die Kristallstruktur des Enzyms aufklären konnte. Das Enzym ist eine sogenannte Zink-Metalloproteinase: ein Protein, welches aus mehreren Untereinheiten organisiert ist und ein Zink-Atom in der Substratbindestelle besitzt.
„Mit diesen strukturbiologischen Einsichten konnten wir aufklären, dass die Ursache für die hohe Selektivität unserer verhältnismäßig kleinen Wirkstoffe auf einem neuartigen, auf diese Weise für die Kollagenasen der Clostridien noch nicht gezeigten Bindungsmodus beruht“, sagt Hartmann. „Diese Ergebnisse liefern den idealen Ausgangspunkt für die Entwicklung neuartiger Anti-Infektiva.“ In zukünftigen Arbeiten müssen die Wirkstoffe vor allem auf ihre Sicherheit für eine mögliche Anwendung im lebenden Organismus untersucht werden.