Nerven steuern die Bakterienbesiedlung des Körpers
Erstmals Zusammenarbeit zwischen Nervensystem und mikrobieller Besiedlung des Körpers belegt
Ein zentraler Aspekt der modernen Lebenswissenschaften ist die Erforschung des symbiotischen Zusammenlebens von Tier, Pflanze und Mensch mit ihren spezifischen bakteriellen Besiedlungen. Die Gesamtheit der Mikroorganismen, die auf und in einem Wirtsorganismus angesiedelt sind, bezeichnen Wissenschaftler als Mikrobiom. Seit einigen Jahren verdichten sich Hinweise, dass die Zusammensetzung und Balance des Mikrobioms eine entscheidende Rolle für die Gesundheit spielen. Störungen der bakteriellen Besiedlung des Körpers dagegen sind insbesondere an der Entstehung verschiedener sogenannter Umwelterkrankungen beteiligt. Wie die Zusammenarbeit von Organismus und Bakterien auf molekularer Ebene abläuft und wie Mikrobiom und Körper dabei als funktionale Einheit agieren, ist bislang allerdings weitgehend unbekannt.
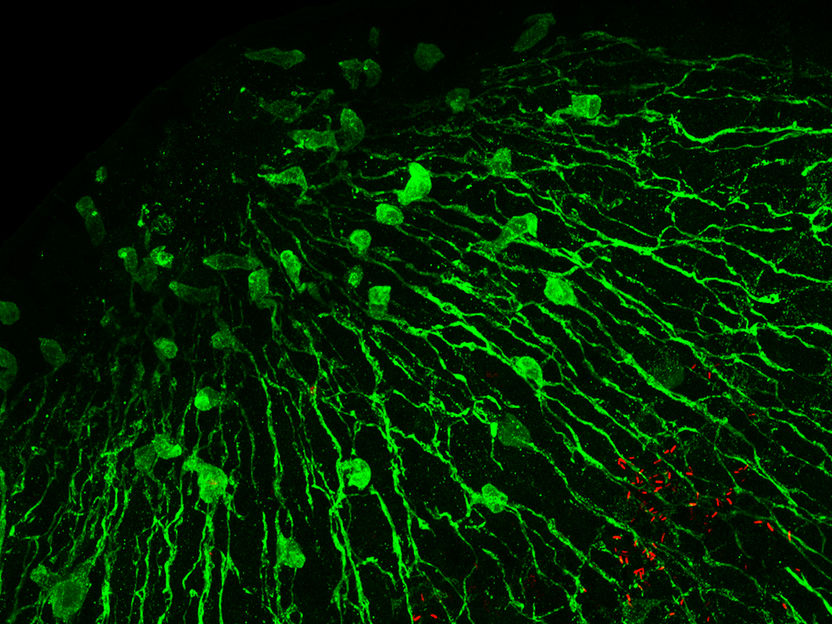
Nervenzellen (grün markiert) des Süßwasserpolypen Hydra produzieren antimikrobielle Peptide und prägen dadurch das Mikrobiom des Tieres. Rot markierte Stäbchenbakterien sind an der Basis der Tentakeln zu erkennen.
Christoph Giez, Dr. Alexander Klimovich
Einen wichtigen Schritt in der Entschlüsselung dieser hochkomplexen Beziehungen ist nun ein Forschungsteam der Arbeitsgruppe Zell- und Entwicklungsbiologie am Zoologischen Institut der Christian-Albrechts-Universität zu Kiel (CAU) gegangen: Am Beispiel des Süßwasserpolypen Hydra untersuchten die Kieler Forschenden gemeinsam mit internationalen Kollegen, wie das einfache Nervensystem dieser Tiere mit ihrem Mikrobiom interagiert. Dabei konnten sie erstmals belegen, dass Nervenzellen kleine Moleküle produzieren, die als Botenstoffe die Zusammensetzung und Ansiedlung spezifischer Bakterienarten im Körper bestimmen. „Bisher waren die Faktoren, die die Bakterienbesiedlung des Körpers beeinflussen, weitgehend unbekannt. Wir konnten zum ersten Mal nachweisen, dass das Nervensystem hier eine wichtige regulierende Rolle übernimmt“, betont Professor Thomas Bosch, Entwicklungsbiologe und Sprecher des von der Deutschen Forschungsgemeinschaft (DFG) geförderten Sonderforschungsbereichs (SFB) 1182 „Entstehen und Funktionieren von Metaorganismen“.
Das von Bosch geleitete Forschungsteam wählte für seine Untersuchungen den entwicklungsgeschichtlich alten Süßwasserpolypen Hydra, ein in Süß- und Fließgewässern lebendes Nesseltier. Seine einfachen Strukturen erleichtern die Erforschung der grundlegenden Strukturen und Funktionsweise des Nervensystems; so verfügt Hydra über einen simplen Körperbau und ein Nervennetz mit nur etwa 3000 einzelnen Nervenzellen. Zugleich weist das Tier trotz seiner Einfachheit bereits zahlreiche molekulare Merkmale höherer Lebewesen auf, die zum Beispiel auch bei den Wirbeltieren noch vorhanden sind. Daher lassen sich am Beispiel dieses Modellorganismus ursprüngliche und daher universell gültige Funktionsprinzipien des Nervensystems ableiten.
Die Kieler Forschenden gingen der Frage nach, wie die als Neuropeptide bezeichneten Botenstoffe des Nervensystems die Zusammenarbeit und Kommunikation von Wirt und Mikroben steuern. Sie fanden zelluläre, molekulare und genetische Belege dafür, dass Neuropeptide eine antibakterielle Wirkung entfalten können und damit die Zusammensetzung und räumliche Verteilung der Bakterienbesiedlung beeinflussen. Um dies zu belegen, konzentrierte sich das Forschungsteam auf die Ausbildung des Nervensystems des Süßwasserpolypen in der individuellen Entwicklung vom Ei bis hin zum ausgewachsenen Tier. Die Nesseltiere entwickeln innerhalb von etwa drei Wochen ein vollständiges Nervensystem; während dieser Zeit ändert sich auch die Bakterienbesiedlung ihres noch unreifen Körpers radikal, bis sich schließlich eine stabile Zusammensetzung des Mikrobioms herausbildet. Unter dem Einfluss der antimikrobiellen Wirkung der Neuropeptide nimmt die Konzentration einer bestimmten Untergruppe von Bakterien, der sogenannten grampositiven Bakterien, im Laufe von etwa vier Wochen stark ab. Am Ende dieses Reifeprozesses herrscht eine typische, insbesondere von gramnegativen Curvibacter-Bakterien dominierte Zusammensetzung des Mikrobioms vor. Da Hydra die steuernden Neuropeptide nur an bestimmten Stellen des Körpers bildet, sorgen sie für eine entsprechende Verteilung der Bakterien entlang der Körperachse des Tieres. So finden sich im Bereich des Kopfes, wo eine starke Konzentration von antimikrobiellen Neuropeptiden herrscht, zum Beispiel sechsmal weniger Curvibacter-Bakterien als in den Tentakeln.
Daraus schlossen die Wissenschaftler, dass das Nervensystem im Laufe der Evolution neben seinen sensorischen und motorischen Aufgaben auch eine steuernde Funktion für das Mikrobiom übernommen hat. „Die neuen Erkenntnisse sind auch im evolutionären Zusammenhang von immenser Bedeutung. Da die Nesseltiere im Laufe der Evolution als erste Organismen ein Nervensystem entwickelten, kann man davon ausgehen, dass sich die Interaktion von Nervensystem und Mikrobiom bereits sehr früh in der Entwicklung des vielzelligen Lebens herausbildete“, betont Bosch. Die an entwicklungsgeschichtlich ursprünglichen Organismen nachgewiesenen Prinzipien seien nicht nur für die Grundlagenforschung interessant. Sie brächten zudem die Chance mit sich, daraus grundlegende neue Erkenntnisse über die Eigenschaften des Nervensystems abzuleiten und das Gelernte in andere Anwendungen zu übertragen. Daher werde sich die weitere Erforschung des Zusammenspiels von Körper und Bakterien künftig stärker auf die neuronalen Aspekte konzentrieren, fasst Bosch die Bedeutung der Arbeit zusammen.
Originalveröffentlichung
René Augustin, Katja Schröder, Andrea P. Murillo Rincón, Sebastian Fraune, Friederike Anton-Erxleben, Ava-Maria Herbst, Jörg Wittlieb, Martin Schwentner, Joachim Grötzinger, Trudy M. Wassenaar, Thomas C.G. Bosch; “A secreted antibacterial neuropeptide shapes the microbiome of Hydra”; Nature Communications; Published on 26.09.2017























































