Wie Zellen ihre eigenen Gene „hacken“
Forscher entschlüsseln neuen Mechanismus der Genexpression
Forscher am Wiener IMBA –Institut für Molekulare Biotechnologie der Österreichischen Akademie der Wissenschaften – sind den molekularen Abwehrstrategien der Zelle gegen Genomparasiten auf der Spur. Nun konnten sie einen neuen Mechanismus nachweisen, bei dem Zellen ihre eigenen Gene „hacken“ um die konventionellen Regeln der Genexpression zu umgehe.
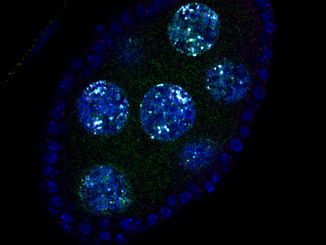
Auf dem Bild zu sehen sind die sich entwickelnden Fortpflanzungsorgane einer weiblichen Furchtfliege, auf welchen die DNA blau eingefärbt wurde. Durch Färbung eines spezifischen Proteins konnten die Forscher den Bereich im Zellkern der Keimzelle bestimmen, in dem die Gene „gehackt“ werden.
Die DNA aller Organismen – vom Hefepilz bis zum Menschen –enthält den Bauplan, sozusagen die „Gebrauchsanleitung“ des Lebens. Doch nur etwa 2% der menschlichen DNA trägt die tatsächliche Information der körpereigenen Gene. Erstaunliche zwei Drittel unseres Genoms bestehen aus „egoistischen“ Genen und deren Relikten. Diese sogenannten Transposons verhalten sich parasitisch und folgen ihrer eigenen Dynamik, die nicht immer im Interesse des Wirtes ist. Um sich zu vermehren, bauen sie Kopien von sich an anderen Stellen des Genoms ein, was die Funktion eines körpereigenen Gens stören und somit Krankheiten auslösen kann. Doch Transposons sind auch eine wichtige Triebfeder für evolutionäre Prozesse, indem sie Mutationen verursachen und die Erbinformation durchmischen.
Vielfältige Abwehrstrategien gegen Genomparasiten
Alle Organsimen haben effektive Abwehrsysteme eingerichtet, um Genomparasiten in Schach zu halten. Bakterien etwa verwenden CRISPR Systeme — berühmt geworden durch die Genschere Cas9 — um Viren und andere eindringende fremde DNA zu zerstören. Die Keimzellen von Tieren verfolgen dabei einen anderen Trick, um Genparasiten lahm zu legen. Sie legen die Stellen im Genom an denen ein Gen-Parasit sitzt einfach still. Dazu verwenden sie kleine RNAs, die sogenannten piRNAs, die in ihrer Sequenz „deckungsgleich“ mit Transposons sind. Als Konsequenz können Transposons ihre schädliche Wirkung nicht mehr entfalten. Ohne piRNAs würden hunderte von Transposons reaktiviert werden, die DNA wäre massiv geschädigt, und der Organismus wäre steril.
Das System hat allerdings eine Schwachstelle: piRNAs sind selber im Genom kodiert, und zwar genau an den Stellen, die voller Transposon-Abschnitte sind. Wie können piRNAs also hergestellt werden, obwohl sie ihren eigenen Ursprungsort lahmlegen?
Die Forschungsgruppe rund um Julius Brennecke ist genau diesem Rätsel auf der Spur und erforscht das Wettrennen zwischen Genomparasiten und Wirtsschutzmechanismen anhand der Fruchtfliege. Erst vor kurzem konnte das Team nachweisen, wie und wo piRNAs in der Zelle richtig zugeschnitten werden, damit sie genau auf die Transposons passen, die es lahmzulegen gilt. Nun haben die Forscher einen neuen Mechanismus entdeckt, bei dem Zellen ihre eigenen Gene „hacken“, um die klassischen Regeln der Genexpression zu umgehen.
Die „Gen-Hacks“ der Zelle zum Schutz des Genoms
Der neuentdeckte Signalweg erklärt, wie Regionen im Genom für die piRNA-Produktion aber nicht für die Transposons selber abgelesen werden kann. Beim herkömmlichen Weg der Genexpression aktivieren Proteine, sogenannte Transkriptionsfaktoren, einen bestimmten DNA Abschnitt, der dann abgelesen wird. Dies funktioniert aber nur, wenn es freien Zugang zur DNA gibt. Dieser jedoch wird durch die Wirkung der piRNAs in Transposonbereichen effektiv blockiert, indem Histon-Proteine, welche DNA verpacken mit bestimmten Signalen versehen werden. Wie die Forscher aktuell in der Zeitschrift Nature berichten, benutzt das piRNA System genau diese Histon-Signale, um die „verpackten“ Gene abzulesen. Vor mehreren Millionen Jahren hat sich ein Protein, welches Histon-Signale zum Lahmlegen der DNA verwendet, verdoppelt. Das neue Schwesterprotein hat sich dann darauf spezialisiert, Proteine zum DNA-Ablesen anstatt zum DNA-Lahmlegen zu rekrutieren.
Peter Andersen, Erstautor der aktuellen Studie erklärt: „Der Signalweg, der in den Geburtsstätten der piRNAs aktiv ist, verbindet durch diesen Trick zwei gegensätzliche Systeme, nämlich Gen-Aktivierung mit Gen-Abschaltung. Wie manche Bastler aus vorgefertigten IKEA Bestandteilen Möbel mit völlig neuen Funktionen bauen, genauso werden bei diesem Gen-‚Hack’ Gene aneinandergekoppelt und umfunktioniert.“
Das Forschungsteam am IMBA konnte so ein „Henne und Ei“ Problem lösen und erklären, wie die unzähligen piRNAs, die unser Genom schützen, genau von jenen Bereichen der DNA gebildet werden, die sie eigentlich stilllegen. „Wir konnten mit dieser Arbeit erstmals zeigen, wie Zellen selbst auf verpackte DNA zugreifen können und wie sie so die Regeln der Genexpression neu schreiben,“ berichtet Julius Brennecke, IMBA Gruppenleiter und Letztautor der Studie. Brennecke geht davon aus, dass ähnliche Systeme „unkonventioneller“ Genexpression im andauernden Kampf zwischen Wirtsgenom und Genomparasiten weit verbreitet sind.