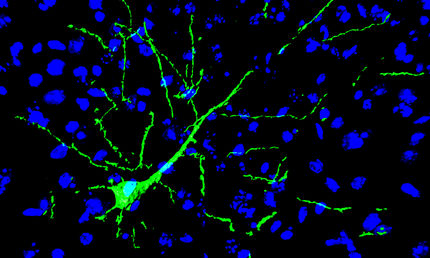
Mini-Gehirn aus der Petrischale
Anzeigen
Eine neue Methode könnte die Erforschung von Entwicklungsstörungen des Gehirns einen wichtigen Schritt voranbringen. Das zeigt eine aktuelle Studie an der Universität Bonn. Die Forscher untersuchten darin die Entstehung eines seltenen angeborenen Gehirn-Defekts. Sie überführten dazu Hautzellen von Patienten in so genannte „Alleskönner“-Stammzellen. Aus diesen generierten sie dann Hirn-Organoide – dreidimensionale kleine „Gewebe-Klümpchen“, deren Aufbau dem des menschlichen Gehirns ähnelt.

Beim Pipettieren: Privatdozent Dr. Philipp Koch, Dr. Julia Ladewig und Vira Iefremova.
(c) Barbara Frommann/Uni Bonn
Mit Hilfe von Humanzellen in der Kulturschale ließ sich die menschliche Hirnentwicklung bislang nur sehr eingeschränkt untersuchen: In der Schale wachsen die Zellen flächig, sie weisen also keine dreidimensionale Architektur auf. Als Alternative stehen Modellorganismen zur Verfügung, zum Beispiel Mäuse. Das Denkorgan des Menschen ist jedoch erheblich komplexer aufgebaut. Entwicklungsstörungen des menschlichen Gehirns lassen sich daher nur bedingt im Tiermodell nachvollziehen.
Wissenschaftler am Institut für Rekonstruktive Neurobiologie der Universität Bonn sind in ihrer Studie einen neuen Weg gegangen: Sie haben dreidimensionale Gewebe-Strukturen in der Zellkulturschale gezüchtet, deren Aufbau dem des menschlichen Gehirns erstaunlich ähnelt. Diese „Mini-Gehirne“ erlauben einen Einblick in die Abläufe, mit denen sich einzelne Nervenzellen zu unserem hoch komplexen Denkorgan organisieren. „Die Methode eröffnet daher ganz neue Möglichkeiten, um Störungen in der Architektur des sich entwickelnden menschlichen Gehirns zu untersuchen“, erklärt Dr. Julia Ladewig, die eine Arbeitsgruppe zur Gehirnentwicklung leitet.
Seltene Gehirnfehlbildung untersucht
Die Wissenschaftler haben in ihrer Arbeit das so genannte Miller-Dieker-Syndrom untersucht. Die Erbkrankheit ist auf einen Chromosomendefekt zurückzuführen. Dieser hat unter anderem eine Fehlbildung der Hirnrinde zur Folge. „Bei Patienten ist die Hirnoberfläche kaum gefurcht, sondern mehr oder weniger glatt“, erklärt Vira Iefremova, Doktorandin und Erstautorin der Studie. Wodurch diese Änderung zustande kommt, wusste man bislang nur in Ansätzen.
Die Forscher stellten zunächst aus Hautzellen von Miller-Dieker-Patienten „Alleskönner“-Stammzellen her, aus denen sie dann Hirn-Organoide züchteten. In Organoiden organisieren sich die Gehirnzellen selbst – ganz ähnlich wie im Gehirn eines Embryos: Die Stammzellen teilen sich; ein Teil der Tochterzellen entwickelt sich zu Nervenzellen; diese wandern dorthin, wo sie gebraucht werden. Diese Prozesse ähneln einem komplizierten Orchesterstück, in dem die Erbanlagen den Taktstock schwingen.
Bei Miller-Dieker-Patienten ist dieser Prozess grundlegend gestört. „Wir konnten zeigen, dass sich bei ihnen die Stammzellen anders teilen“, erklärt Privatdozent Dr. Philipp Koch, der die Studie gemeinsam mit Dr. Julia Ladewig geleitet hat. „Bei Gesunden vermehren sich die Stammzellen zunächst einmal und bilden dabei geordnete, dicht gepackte Schichten. Nur ein kleiner Teil von ihnen differenziert sich und wird zum Beispiel zu Nervenzellen.“
Für die dichte und gleichmäßige Packung der Stammzellen sind bestimmte Proteine verantwortlich. Die Bildung dieser Moleküle ist bei Kranken gestört. Dadurch sind die Stammzellen nicht so eng gepackt und gleichzeitig nicht so regelmäßig angeordnet. Diese schlechte Organisation führt unter anderem dazu, dass sich die Stammzellen frühzeitiger differenzieren. „Die Änderung der dreidimensionalen Gewebe-Struktur führt also ursächlich zu einem geänderten Teilungsverhalten“, sagt Ladewig. „Dieser Zusammenhang ist weder im Mausmodell noch in zweidimensionalen menschlichen Kultursystemen erkennbar.“
Neue Therapieoptionen seien damit allerdings nicht in Sicht, betont die Wissenschaftlerin. „Wir betreiben hier Grundlagenforschung. Unsere Ergebnisse zeigen aber, dass Organoide das Zeug dazu haben, eine neue Ära in der Hirnforschung einzuleiten. Und wenn wir die Entwicklung unseres Denkorgans besser verstehen, erwachsen daraus langfristig vermutlich auch neue Behandlungsmöglichkeiten für Krankheiten.“
Originalveröffentlichung
Vira Iefremova, George Manikakis, Olivia Krefft, Ammar Jabali, Kevin Weynans, Ruven Wilkens, Fabio Marsoner, Björn Brändl, Franz-Josef Müller, Philipp Koch und Julia Ladewig; "An Organoid-Based Model of Cortical Development Identifies Non-Cell-Autonomous Defects in Wnt Signaling Contributing to Miller-Dieker Syndrome"; Cell Reports; 2017