Sauerstoffmangel macht Tumorzellen zu gefährlichen „Schläfern“
Lange galt es als ausgemachte Sache: Der durch humane Papillomviren (HPV) ausgelöste Gebärmutterhalskrebs ist auf zwei bestimmte Virusproteine angewiesen. Fehlen sie, so stellen die Krebszellen dauerhaft ihr Wachstum ein. Wissenschaftler im Deutschen Krebsforschungszentrum entdeckten nun, dass die Krebszellen unter dem im Tumor häufigen Sauerstoffmangel die Produktion dieser Virusproteine drosseln. Allerdings bewirkt das keinen endgültigen Wachstumsstopp, sondern führt zu einem Schlafzustand, aus dem die Krebszellen wieder aufwachen können, sich weiter vermehren und so möglicherweise zur Rückkehr der Erkrankung führen.
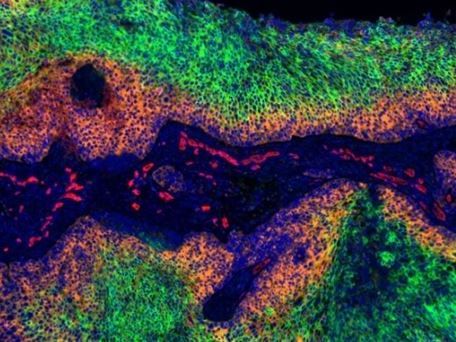
Gebärmutterhalskrebs: In den grün gefärbten Bereichen des Tumors herrscht Sauerstoffmangel. Dort bilden die Krebszellen kein HPV-E7 (orange). Zellkerne sind blau, Blutgefäße rot markiert.
© Dr. Arnulf Mayer, Universität Mainz
Humane Papillomviren (HPV) gelten als Ursache für etwa fünf Prozent aller Krebserkrankungen weltweit. In erster Linie verursachen sie Gebärmutterhalskrebs, aber auch viele bösartige Tumoren im Kopf-Halsbereich, an den Geschlechtsorganen und in der Analregion gehen auf ihr Konto.
Forscher konnten schon vor einiger Zeit entschlüsseln, wie die Viren Zellen entarten lassen: Zwei HPV-Proteine, E6 und E7, hebeln in den infizierten Zellen die beiden wichtigsten Krebsbremsen aus und sind so dafür verantwortlich, dass Krebs entsteht.
„E6 und E7 kurbeln das Krebswachstum an, indem sie die „Seneszenz“ verhindern, eine Art der Zellalterung, die mit einem irreversiblen Wachstumsstopp verbunden ist“, erklärt Felix Hoppe-Seyler vom Deutschen Krebsforschungszentrum. Werden E6 und E7 blockiert, so stellen Krebszellen ihr Wachstum ein. „Unser Wissen über die Funktionen von E6 und E7 beruht jedoch größtenteils auf Ergebnissen aus Zellkulturen, wo man mit hoher Sauerstoffsättigung arbeitet. In vielen Krebsgeschwüren gibt es aber Regionen mit Sauerstoffmangel, weil sie nicht ausreichend von Blutgefäßen versorgt werden. Wir wollten nun wissen, was unter Sauerstoffmangel passiert“, erklärt Hoppe-Seyler.
Senkten die Wissenschaftler die Sauerstoffkonzentration in der Kulturschale so, dass sie der im schlecht versorgten Tumorgewebe entsprach, so drosselten die Krebszellen die Produktion von E6 und E7 und stellten ihr Wachstum ein. Jedoch leiteten sie nicht die Seneszenz ein, sondern verfielen in eine Art von Schlafzustand. Bekamen sie wieder Sauerstoff, so erwachten die „Schläfer“ und setzten sogleich die Zellteilung fort.
Die Schläfer, die sich in Tumorregionen mit geringem Sauerstoffgehalt bilden können, sind resistenter gegenüber Chemotherapie, die sich bevorzugt gegen teilende Zellen richtet. Zudem entziehen sie sich der Immunabwehr, da sie keine HPV-Proteine mehr ausbilden, an denen sie die Abwehrzellen erkennen könnten.
E6 und E7 galten bislang als ideale molekulare Angriffsziele für eine zielgerichtete Behandlung HPV-bedingter Tumoren, an der intensiv geforscht wird. Doch auch solche Medikamente könnten den Schläfern nichts anhaben, da ihnen ja gerade die entscheidenden Zielmoleküle fehlen.
„Für Patienten mit HPV-bedingten Tumoren stellen die Schläferzellen eine latente Gefahr dar: Schrumpft ein Tumor, beispielsweise nach einer erfolgreichen Therapie, und erhalten überlebende Schläfer wieder Anschluss an Gefäßversorgung und Sauerstoffzufuhr, so könnten sie für eine Wiederkehr der Erkrankung sorgen“, ordnet Hoppe-Seyler die Ergebnisse ein und ergänzt: „Bei der Entwicklung neuer Therapien dürfen wir uns nicht allein auf die Zielmoleküle E6 und E7 konzentrieren, sondern müssen auch Strategien entwickeln, die die Schläferzellen ausschalten.“
Die Untersuchungen wurden von der Wilhelm Sander-Stiftung und der Deutschen Krebshilfe gefördert.
Originalveröffentlichung
Karin Hoppe-Seyler, Felicitas Bossler, Claudia Lohrey, Julia Bulkescher, Frank Rösl, Lars Jansen, Arnulf Mayer, Peter Vaupel, Matthias Dürst, and Felix Hoppe-Seyler; "Induction of Dormancy in Hypoxic Human Papillomavirus-Positive Cancer Cells"; Proceeding of the National Academy of Science (PNAS); 2017
Meistgelesene News
Originalveröffentlichung
Karin Hoppe-Seyler, Felicitas Bossler, Claudia Lohrey, Julia Bulkescher, Frank Rösl, Lars Jansen, Arnulf Mayer, Peter Vaupel, Matthias Dürst, and Felix Hoppe-Seyler; "Induction of Dormancy in Hypoxic Human Papillomavirus-Positive Cancer Cells"; Proceeding of the National Academy of Science (PNAS); 2017
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Jede einzelne Zelle zählt – schon vor der Geburt! - Bestimmte Immunzellen entstehen früh im Leben und bleiben ein Leben lang
Services von Trenzyme nach ISO 9001 zertifiziert
Wie COVID-19 das Herz dauerhaft schädigt - Forschungsteam zeigt erstmals auf, wie die Entzündung bei COVID 19 die kleinsten Gefäße im Herzen verändert
Zahnimplantat
Von der Krankheit der anderen lernen - Das Hundestaupevirus dient als Modell für zwei Erkrankungen des Menschen

Schneller Test für neutralisierende Antikörper gegen Sars-Cov-2 - Keine aufwendigen Sicherheitsvorkehrungen notwendig

Alzheimer-Auslöser enttarnt - Beta-Amyloid-Fibrillen aus menschlichem Gewebe aufbereitet
Achillesferse von Bakterien entdeckt

Höhere Antioxidantienkonzentrationen stehen in Zusammenhang mit einem geringeren Demenzrisiko

Lastenaufzug hilft Bakterien eine Tarnkappe zu bauen - „Unsere Ergebnisse stellen einen echten Durchbruch dar, da schon seit circa 20 Jahren versucht wurde die Struktur eines TRAP Transporters zu entschlüsseln“