Mit Molekülen und Licht an Zellen zupfen
Neue Methode zur Zellstimulation
Jeder Mensch besteht aus etwa 100 Billionen Zellen – aneinandergereiht würden sie 60-mal um den Erdball reichen. Die meisten dieser Zellen entstehen durch Teilung und Differenzierung einer einzigen Eizelle. Zur Orientierung erkunden sie laufend ihre Umgebung und kommunizieren mit ihren Nachbarn, indem sie an anderen Zellen oder Oberflächen haften. Zwei Arbeitsgruppen aus der Chemie und der Biophysik der Christian-Albrechts-Universität zu Kiel (CAU) haben eine neue Methode entdeckt, um Zellen zu stimulieren und damit ihre Haftung zu verstärken.
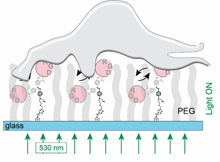
Von unten eingestrahltes grünes Licht bringt Signalmoleküle (RGD) zum Vibrieren. Dieser mechanische Reiz stimuliert Zellen so, dass sie an der Oberfläche haften.
Rainer Herges
Zellen werden permanent von Bakterien attackiert, die versuchen, in sie einzudringen. Nützliche Bakterien dagegen leben friedlich auf der menschlichen Haut oder helfen bei der Verdauung. Um Freund und Feind voneinander zu unterscheiden oder um sich selbst entsprechend ihrer Nachbarzellen zu differenzieren, müssen Zellen ständig kommunizieren und ihre Umgebung sondieren. Dafür suchen sie den direkten Kontakt zu anderen Zellen oder zu ihrer Umgebung. „Schwimmen Zellen einzeln in einer Lösung und treffen dann auf eine Oberfläche, sondieren sie zunächst, ob es sich um einen geeigneten Ort handelt, um sich niederzulassen. Ist das der Fall, strecken sie Proteinfühler aus, um sich festzuhalten. Andere Zellen folgen und es entsteht ein Zellgewebe“, erklärt dazu Rainer Herges, Professor am Institut für Organische Chemie.
Werden Zellen stimuliert, haften sie schneller
Dass Zellen auf bestimmte Oberflächenstrukturen und deren chemische Zusammensetzung reagieren, ist in der Forschung schon länger bekannt. Auch gab es bereits Hinweise darauf, dass nicht nur statische Reize, sondern dynamische Vorgänge, also Bewegungen und mechanische Kräfte, ebenfalls attraktiv auf Zellen wirken. Wird zum Beispiel mit feinen Nadeln an Zellen gezogen, regt sie das an, ihre Haftung zu verstärken. „Dies ist jedoch keine sehr subtile, kontrollierte Methode, denn dadurch können sehr viele verschiedene zelluläre Prozesse beeinflusst werden“, berichtet Christine Selhuber-Unkel, Professorin für Biokompatible Nanomaterialien am Institut für Materialwissenschaft der Universität Kiel.
Sehr viel ausgeklügelter ist der Weg, den Selhuber-Unkel und Herges jetzt gefunden haben, um Zellen zu stimulieren. Sie verknüpfen chemische Erkennungsstrukturen (sogenannte RGDs), die von den Zellen erkannt werden, mit Oberflächen. Diese Signalmoleküle stehen aber nicht statisch auf den Oberflächen, sondern können mit Licht bewegt werden: In der Leine, die die RGDs mit den Oberflächen verbindet, sind winzige, molekulare Schalter eingebaut. Bei der Bestrahlung mit grünem Licht biegen sich diese Moleküle etwa 1000-mal pro Sekunde hin und her. „Diese Vibration überträgt sich auf die RGDs, die wiederum an den Zellen ‚zupfen‘. Die Zellen scheinen diese Art von Stimulation zu spüren: Sie haften schneller und fester an der Oberfläche“, erklärt Selhuber-Unkel. Gemessen wurde diese Haftkraft mithilfe eines Rasterkraftmikroskops. Dass die Zellen auf diesen Reiz reagieren, zeigt auch ihre vermehrte Herstellung von Haftproteinen.
Licht als „Nanoskalpell“ denkbar
Aus der Entdeckung der Kieler Forscherinnen und Forscher ergeben sich zahlreiche potentielle Anwendungen. Die molekularen Vibratoren lassen sich direkt in Zellmembranen einbauen – Zellen wären darüber mit Licht steuerbar. „Langfristig ist auch der Einsatz von Licht als eine Art ‚Nanoskalpell‘ denkbar, durch das extrem präzise mikroskopische Eingriffe ermöglicht werden können“, überlegt Herges weiter.
Im Sonderforschungsbereich (SFB) 677 „Funktion durch Schalten“ wird schon lange geforscht, wie Zellen über molekulare Schalter mit Licht indirekt stimuliert werden können. „Die Stimulation über Licht hat eine Reihe von Vorteilen. Zum einen kann es sehr schnell und nach Belieben ausgeschaltet werden“, erklärt SFB-Leiter Herges. „Vor allem aber kann man Zellen mit gebündeltem Licht auf etwa 300 Nanometer punktgenau bestrahlen. So können wir herausfinden, welche Bereiche auf der Zelle für die Haftung verantwortlich sind und damit die Mechanismen der Zellhaftung aufklären.“ Im Rahmen des SFB 677 kam die interdisziplinäre Zusammenarbeit auch zustande: Michelle Holz und Grace Suana aus der Arbeitsgruppe um Rainer Herges aus der Organischen Chemie synthetisierten die Schaltmoleküle und Oberflächen. Laith F. Kadem aus der Arbeitsgruppe von Christine Selhuber-Unkel führte die Zellexperimente durch.