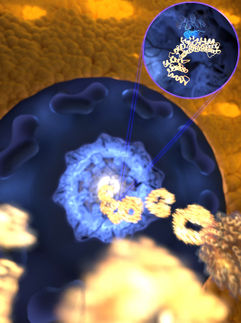
Proteinforschung: Molekulare Schalter im Detail erforscht
Anzeigen
Bei allen möglichen Prozessen im Körper haben molekulare Schalter das Sagen. Funktionieren sie nicht, werden wir krank.

Sie bringen Licht ins Zusammenspiel der Proteine: Klaus Gerwert, Carsten Kötting und Daniel Mann (von links).
© RUB, Marquard
Sehen, Riechen, Schmecken, Blutdruckregulation – an allen diesen Prozessen sind molekulare Schalter beteiligt. Den Mechanismus, mit dem diese Proteine ausgeschaltet werden, hat ein Forscherteam der Ruhr-Universität Bochum (RUB) um Prof. Dr. Klaus Gerwert und Privatdozent Dr. Carsten Kötting untersucht. Sie nutzten dafür die Infrarotspektroskopie (FTIR) und Computersimulationen und konnten den Prozess auf subatomarer Ebene beschreiben.
Für das Ausschalten vieler Proteinschalter ist das Energiespeichermolekül GTP entscheidend, das an die Proteine gebunden ist. Spaltet ein Enzym eine Phosphatgruppe von GTP ab, wird das Schalterprotein ausgeschaltet. Diese sogenannte GTP-Hydrolyse läuft innerhalb von Sekunden ab und wird vor allem von einer besonderen Aminosäure erledigt, dem Arginin-Finger. Funktioniert dieser Prozess nicht richtig, kommt es zum Beispiel zur Cholera-Erkrankung. Wie der Arginin-Finger genau arbeitet, konnten die Forscher dank einer Kombination aus Methoden der Biologie, der theoretischen Physik und der Experimentalphysik erstmals im Detail beschreiben.
Mikroskop mit subatomarer Auflösung
Eine am RUB-Lehrstuhl für Biophysik etablierte Methode erlaubt es, enzymatische Prozesse mit hoher zeitlicher und räumlicher Auflösung in ihrem natürlichen Zustand zu verfolgen. Es handelt sich dabei um eine besondere Form der Spektroskopie, die zeitaufgelöste Fourier-Transform-Infrarotspektroskopie, kurz FTIR. Allerdings geben die damit gemessenen Daten keine Auskunft darüber, an welcher Stelle des Enzyms ein Prozess gerade stattfindet. Diese Information können die Forscher durch quantenmechanische Computersimulationen von Strukturmodellen gewinnen. „Durch Kombination von Theorie und Experiment erhält man so ein Mikroskop mit subatomarer Auflösung“, erklärt Klaus Gerwert.
Mit diesem Ansatz fanden die Forscher im Detail heraus, wie die GTP-Hydrolyse beschleunigt wird: Der Arginin-Finger wechselt beim schnellen Ausschalten wie bei einem Fingerschnipp die Position.
Defekter Schalter kann zu Krebs führen
Dieses Ergebnis ist bedeutend, weil der enzymatische Prozess der GTP-Hydrolyse als molekularer Schalter häufig vorkommt. Die Mechanismen der verschiedenen Schaltprozesse im Körper unterscheiden sich nur im Detail. Die GTP-Hydrolyse ist zum Beispiel auch ein Schalter für das Protein Ras, dessen Fehlfunktion zu unkontrolliertem Zellwachstum bei Tumoren führt. „Indem wir die Ergebnisse unserer Untersuchungen an verschiedenen Schaltprozessen verknüpfen, bringen wir immer weitere Details der GTP-Hydrolyse ans Licht“, so Carsten Kötting.
So visualisierten die Wissenschaftler spektroskopisch den Zustand des Arginin-Fingers gebunden an das GTP-Molekül mit einer Genauigkeit von einem Hundertstel Atomdurchmesser. Der Arginin-Fingerschnipp hat große Auswirkungen auf Geometrie und Ladungsverteilung des Bindungspartners. „Unser Fernziel ist es, durch diese Grundlagenforschung einmal zur Entwicklung von Medikamenten gegen Krebs und schwerwiegende Erbkrankheiten beizutragen“, so Daniel Mann vom Forscherteam.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!