Eine giftige Kugel, die an der bakteriellen Konkurrenz beteiligt ist
Anzeigen
Ein bakterielles Gift, das es einem infektiösen Bakterienstamm ermöglicht, seine Konkurrenten zu besiegen, wurde von Wissenschaftlern des Imperial College London entdeckt.
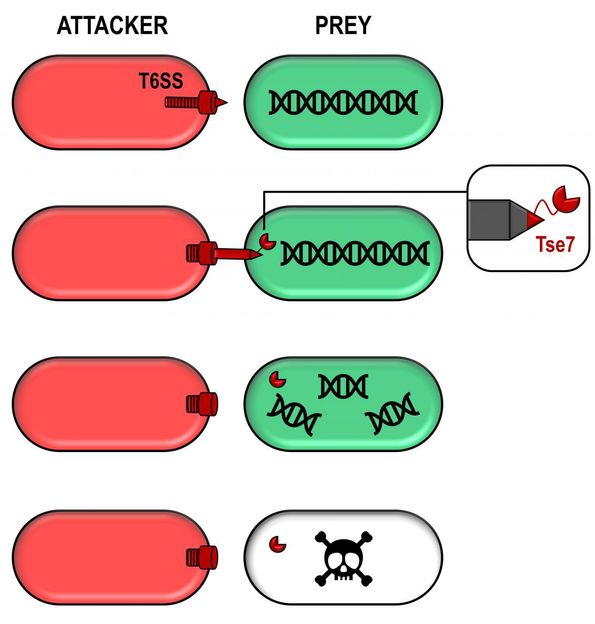
Wie die neu entdeckte giftige Kugel Wettbewerber tötet
Imperial College London
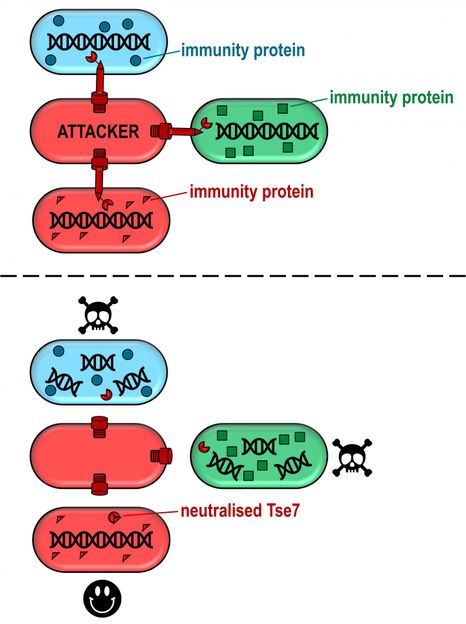
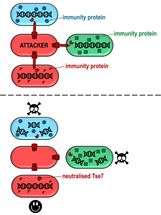
Oben: ein angreifendes Bakterium, das Toxin in drei verschiedene Stämme von P. aeruginosa injiziert. Die blauen und grünen Sorten haben unterschiedliche Verisonen des Immunitätsproteins. Der rote Stamm wurde mit dem Immunitätsprotein des Angreifers injiziert. Unten: Die blauen und grünen Stämme werden geschädigt und sterben schließlich ab, während die roten Bakterien geschützt sind.
Imperial College London
Der Befund liefert ein besseres Verständnis der Mechanismen der bakteriellen Kriegsführung, die der erste Schritt zur Entwicklung verbesserter Behandlungsmethoden für mikrobielle Erkrankungen ist.
Bakterien gehören zu den am häufigsten vorkommenden Organismen auf der Erde und führen einen unerbittlichen Kampf um die begrenzten Nahrungsressourcen, die ihnen zur Verfügung stehen. Um Rivalen und Raubtiere abzuwehren und zu eliminieren, haben sie mehrere chemische Waffen entwickelt.
Bakterielle Sekretionssysteme, die mit kugelartigen Toxinen beladen werden können, sind eine Art von Waffen, mit denen Bakterien ihre Konkurrenten eliminieren. In einer neuen Studie haben kaiserliche Forscher ein neues kugelartiges Gift entdeckt, das von Pseudomonas aeruginosa produziert wird, einem Bakterium, das für menschliche Krankheiten wie Lungenentzündung und Mukoviszidose sowie viele im Krankenhaus erworbene Infektionen verantwortlich ist.
Die Studie unter der Leitung von Professor Alain Filloux vom Department of Life Sciences untersuchte eine untersuchte Gruppe von Bakteriengenen, die Proteine kodieren, die mit dem Sekretionssystem Typ 6 (T6SS) von P. aeruginosa verbunden sind. T6SS ist eine molekulare Waffe, die für die Verabreichung mehrerer Toxine verantwortlich ist, die das Wachstum konkurrierender Bakterien abtöten oder unterdrücken.
Proben von P. aeruginosa aus spezifischen Infektionen werden oft von einem einzigen Stamm von P. aeruginosa dominiert, und die Forscher schlagen vor, dass dieses neu entdeckte Toxin helfen könnte, zu erklären, warum eine solche Dominanz möglich ist.
sagte Professor Filloux: "Es gibt noch viel mehr zu erfahren über die genaue Rolle von T6SS bei der Gestaltung der Zusammensetzung von Bakteriengemeinschaften bei P. aeruginosa-Infektionen, was es uns letztendlich ermöglichen würde, unser grundlegendes Verständnis dieses Systems zur Lösung gesundheitlicher Probleme zu nutzen."
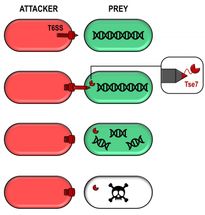
Unter den T6SS-bezogenen Genen, die in P. aeruginosa untersucht wurden, fand man ein Protein, das in der Lage ist, Nukleinsäuren wie DNA abzubauen. Dieses Protein, das die Forscher Tse7 nannten, wirkt wie eine giftige Kugel, die über das T6SS an eine Konkurrenzzelle abgegeben werden kann.
Sie passt perfekt auf die Spitze der T6SS-Pistole und macht ihre Lieferung sehr effizient. Als Tse7 in verschiedene Bakterien eingeführt wurde, war es in der Lage, ihre DNA abzubauen und schließlich ihr Wachstum zu stoppen, was ihre toxische Aktivität zeigt.
In der mikrobiellen Welt gibt es eine Fülle von verschiedenen Toxinen mit einer Vielzahl von Funktionen, von denen diejenigen, die DNA abbauen, wie Tse7, bis hin zu denen, die den Zellabbau verursachen, indem sie die essentielle Bakterienmembran ihrer Opfer zerstören.
Aber jedes Bakterium, das ein Gift produziert, muss sich auch irgendwie davor schützen, von seiner eigenen Waffe zerstört zu werden. Deshalb wird neben dem Toxin auch ein Immunitätsprotein - ein Antitoxin - produziert, das die toxinproduzierenden Bakterien immun gegen ihre eigenen Waffen macht. Die aktuelle Studie hat ergeben, dass P. aeruginosa ein Tse7-Immunitätsprotein namens Tsi7 besitzt, das bei der Einführung in die Opferzellen diese vor der Tse7-Toxizität schützt.
Es wurde auch gezeigt, dass das Tsi7-Immunitätsprotein sehr spezifisch für den Stamm ist, der es produziert, d.h. verschiedene P. aeruginosa-Stämme haben einzigartige Versionen von Tsi7, die nur vor dem Gift schützen, das aus dem gleichen Stamm stammt. Diese Stammspezifität des Toxin-Immunitätspaares könnte erklären, warum Proben von P. aeruginosa-Infektionen von Mukoviszidosepatienten eher von einem einzigen Pseudomonas-Stamm dominiert werden.
Panayiota Pissaridou, eine Doktorandin bei Imperial und eine der beiden Hauptautoren in der vorliegenden Studie, sagte: "Es gibt viele Toxine in P. aeruginosa, die noch nicht untersucht wurden". Dr. Luke Allsopp, ebenfalls Hauptautor dieser Studie, fügte hinzu: "Weitere Forschungen über das T6SS und wie es Bakterien erlaubt, sich an verschiedene Umgebungen anzupassen, sind wichtig, um die Mechanismen zu verstehen, die klinische Infektionen steuern".