Eingebauter Schutzmechanismus gegen Entzündungen
Kieler Forscher untersuchen Wirkungsweise von Immunzellen
Anzeigen
Das Protein Interleukin-6 (IL-6) kann in Zellen verschiedene Funktionen übernehmen, je nachdem wie es Zellen aktiviert. Regt es Zellen über den klassischen Signalweg an, hilft es bei der Regeneration von Gewebe und ist unentbehrlich bei der Bekämpfung von bakteriellen Infektionen. Aktiviert es jedoch über den sogenannten „trans-Signalweg“, fördert das Protein Entzündungen. Eine Blockade dieses Signalwegs führt bei vielen entzündlichen Erkrankungen zu einer deutlichen Verbesserung der Symptome und wird unter anderem zur Behandlung der Rheumatoiden Arthritis genutzt. Wissenschaftler der Christian-Albrechts-Universität zu Kiel (CAU) haben jetzt im Journal of Biological Chemistry gezeigt, dass menschliche Immunzellen einen eingebauten Schutzmechanismus besitzen, der ihre Aktivierung über den trans-Signalweg verhindert.
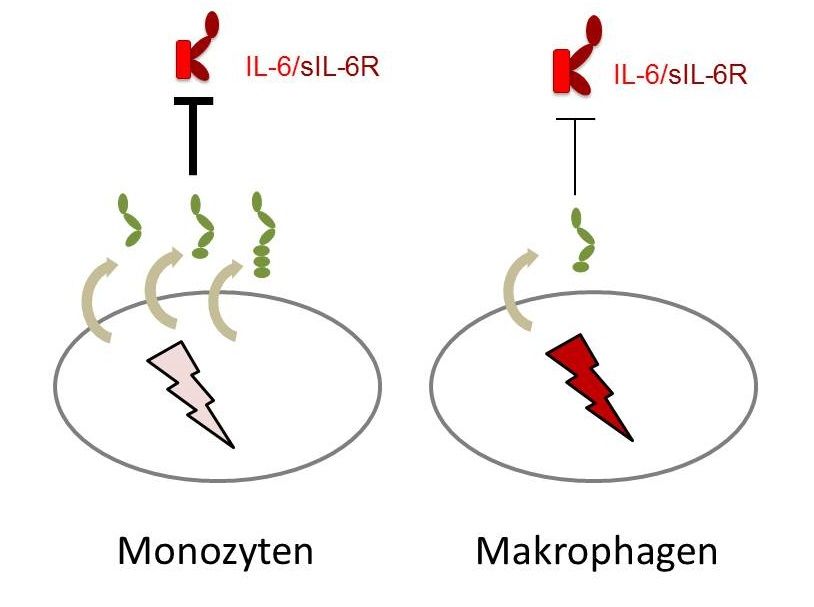
Monozyten, die zu den Leukozyten, also weißen Blutkörperchen, gehören, sondern besonders viele der längsten Formen des lösliches Rezeptors gp130 ab (in grün) und sind damit besonders stark geschützt. Differenzieren sie sich zu Makrophagen aus, verlieren sie diese Eigenschaft jedoch fast völlig.
Dr. Christoph Garbers
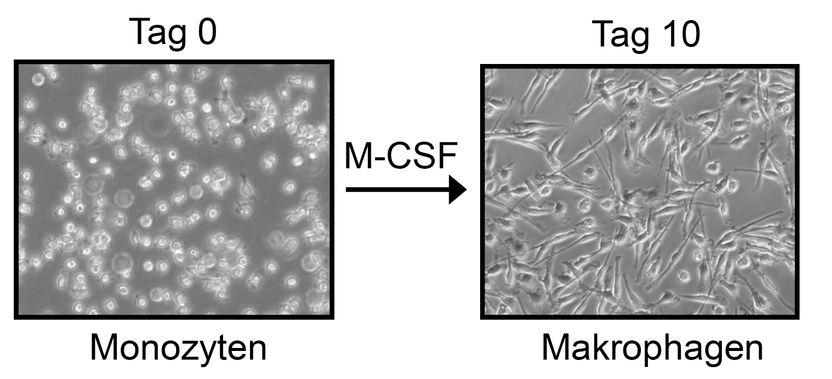
Mikroskopische Aufnahme von Monozyten (links), aus denen die Forscherinnen und Forscher über zehn Tage durch Zugabe des Zytokins M-CSF (Monozytenkolonien-stimulierender Faktor) Makrophagen differenziert haben.
Dr. Christoph Garbers
Das Protein Interleukin-6 (IL-6) entfaltet seine unterschiedlichen Wirkungen, indem es sich an Interleukin-6-Rezeptoren (IL-6R) bindet. Diese Rezeptoren existieren in zwei Ausführungen: membrangebunden und löslich. Die membrangebundenen Formen des Rezeptors sind nur auf wenigen Zellen im menschlichen Körper vorhanden. Über diesen „klassischen Signalweg“ werden die regenerativen Eigenschaften des IL-6 aktiviert. Die löslichen Formen des Rezeptors dagegen können über den „trans-Signalweg“ praktisch alle Körperzellen unkontrolliert aktivieren. „Es wird angenommen, dass insbesondere dieser Signalweg für die Auslösung der entzündungsfördernden Aktivitäten von IL-6 verantwortlich ist. Damit stellt eine spezifische Hemmung des ‚trans-Signalwegs‘ eine mögliche therapeutische Option dar“, sagt Dr. Christoph Garbers vom Biochemischen Institut der CAU. Zugelassen ist bisher ein Antikörper, der den IL-6R blockt und damit die Aktivität des Proteins stoppt.
Zusammen mit Kollegen aus Kopenhagen und Hamburg konnten die Kieler Forschenden jetzt zeigen, dass Immunzellen auch einen eingebauten Schutzmechanismus besitzen, um sich gegen die unkontrollierte Aktivierung zu schützen. Hierfür sondern sie lösliche Formen des signaltransreduzierenden Rezeptors gp130 ab. Er ist in der Lage, sich an den Komplex aus dem Protein IL-6 und dem Rezeptor sIL-6R zu binden und damit dessen aktivierende Wirkung zu neutralisieren.
Dass drei unterschiedlich lange Formen des löslichen gp130 existieren, war in der Forschung bereits bekannt. „Aber welche Zellen welche Formen bilden können und viel wichtiger, warum es überhaupt verschieden lange Formen gibt, hat bisher noch niemand untersucht“, sagt Garbers. Die Länge der gp130-Formen beeinflusst die Stabilität und die Wirksamkeit des Rezeptors: Längere Formen können IL-6 trans-Signale wirkungsvoller blocken als kürzere. „Wir denken, dass die kürzeren Rezeptoren zur Feinsteuerung dienen. Somit hat die Zelle verschiedene Stellschrauben, um sich gegen eine unkontrollierte Aktivierung zu wehren.“ Ob diese Blockierung auch von außen gesteuert werden kann, ist eines der Themen, das die Forschenden als nächstes bearbeiten wollen. „Könnten wir Zellen dazu bringen, besonders viel von der langen Form des gp130 abzusondern, könnte das in der Behandlung von entzündlichen Erkrankungen eingesetzt werden.“
Das Forschungsteam fand noch mehr über den Rezeptor gp130 heraus: Nicht nur er kann sich in seiner Wirkungsweise unterscheiden, sondern auch die Zellen, in denen er auftritt. „Interessanterweise zeigen unterschiedliche Immunzellen ein unterschiedliches Expressionsmuster der drei löslichen gp130-Formen. Damit sind die Zellen unterschiedlich gut in der Lage, sich selbst gegen den IL-6 trans-Signalweg zu schützen“, so Garbers. „Besonders auffällig ist, dass Monozyten, die zu den Leukozyten, also weißen Blutkörperchen, gehören, sehr viel lösliches gp130 in seiner längsten Form absondern und damit stark geschützt sind – das aber völlig verlieren, wenn sie sich zu Makrophagen ausdifferenzieren.“
Bisher nicht untersucht wurde, wie sich das gp130-Muster bei Erkrankungen ändert. „Als nächstes wollen wir schauen, ob es bei entzündlichen Erkrankungen zu Änderungen kommt. Sollte sich zum Beispiel zeigen, dass hierbei mehr kürzere Formen gebildet werden, würde das erklären, warum das Protein IL-6 so stark entzündungsfördernd wirkt“, blickt Garbers weiter.























































