Wie ein Protein Immunzellen in den Suizid treibt
Anzeigen
Für manch einen Krankheitserreger bedeutet Angriff die beste Verteidigung – sie nisten sich direkt in die Abwehrzellen des menschlichen Körpers ein. Wenn sie jedoch in ihrem Versteck aufgespürt werden, bringt sich die infizierte Zelle selber um und setzt so die Erreger wieder frei. Im EMBO Journal berichtet ein Forscherteam vom Biozentrum der Universität Basel, dass ein Protein namens Gasdermin durchlässige Poren in der Membran bildet und so den Suizid der Immunzelle auslöst.
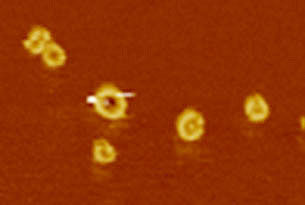
Bild der Poren in der Zellmembran, aufgenommen mit dem Rasterkraftmikroskop.
University of Basel, Biozentrum
Ein gutes Versteck bietet oftmals der Angreifer selbst. Auch einige Bakterien wie der Tuberkulose- oder Typhus-Erreger haben das erkannt. Sie dringen in Abwehrzellen ein und können dort gut versteckt längere Zeit überleben. Die Makrophagen erwehren sich solcher Eindringlinge, indem sie ein Selbstmordprogramm starten. Gemeinsam mit Forschern des Novartis Institute of Biomedical Research und der ETH Zürich hat das Team um Prof. Sebastian Hiller vom Biozentrum der Universität Basel nun erstmals zeigen können, dass ein «Todesprotein» die Zellmembran durchlöchert und die Makrophagen so zum Platzen bringt. Die dadurch freigesetzten Krankheitserreger können nun erneut durch das Immunsystem bekämpft werden.
Gasdermin D: Henker in der Zelle
Eingedrungene Krankheitserreger verraten sich durch winzige Zellbestandteile, die von Rezeptoren im Inneren der Makrophagen erkannt werden. Diese setzen daraufhin eine Signalkette in Gang, die Entzündungsreaktionen auslöst und den Befehl zur Einleitung der Pyroptose – einer Form des programmierten Zelltods – gibt. «Einige Studien belegten bereits, dass das Protein Gasdermin D eine zentrale Rolle bei der Pyroptose spielt», erklärt Prof. Petr Broz, einer der Hauptautoren der Studie. «Wir haben nun herausgefunden, wie genau Gasdermin die Immunzellen in den Suizid treibt und konnten mithilfe der Kryoelektronen- und Rasterkraftmikroskopie zum ersten Mal die Poren in der Membran sichtbar machen.»
Das Protein Gasdermin D steht am Ende einer langen Signalkette. So alarmieren Rezeptoren die Zelle über fremde Bakterienbestandteile und regen den Zusammenbau des Inflammasoms an. Dieser Proteinkomplex wiederum aktiviert Enzyme, die Gasdermin aufspalten und in seine aktive Form überführen. «In den Makrophagen ist Gasdermin der Scharfrichter, der das Todesurteil vollstreckt», verdeutlicht Hiller die Aufgabe des Proteins. «Das abgespaltene Gasdermin-Fragment wandert in Richtung Zellmembran, baut sich dort ein und formt zusammen mit weiteren solcher Fragmente eine durchlässige Pore. Die löchrige Membran lässt die Zelle anschwellen, bis sie schliesslich platzt.»
Kooperation von Gasderminen bei Zell-Suizid
Mit Gasdermin D haben die Forscher nicht nur das Protein identifiziert, welches den Immunzellen den Todesstoss versetzt, sondern konnten auch mit hochauflösenden Mikroskopiertechniken sichtbar machen, auf welche Weise dies geschieht. Wie sich herausstellte, braucht es nach der Aufspaltung von Gasdermin D nur eines der beiden Fragmente für einen reibungslosen Einbau in die Zellmembran. Gasdermine sind eine bis jetzt kaum erforschte Proteinfamilie, die neben Gasdermin D noch fünf weitere Mitglieder zählt. Zukünftig möchten Hiller und sein Team die Struktur und Funktionsweise weiterer Mitglieder der Gasderminfamilie untersuchen, um herauszufinden, ob und wie sie bei der Porenbildung miteinander kooperieren und unter welchen physiologischen Bedingungen diese Proteine den Zell-Suizid ausführen.
Originalveröffentlichung
Lorenzo Sborgi, Sebastian Rühl, Estefania Mulvihill, Joka Pipercevic, Rosalie Heilig, Henning Stahlberg, Christopher J. Farady, Daniel J. Müller, Petr Broz and Sebastian Hiller; "GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death"; EMBO Journal; published online 14 July 2016