Ein negatives Enzym liefert positive Resultate
Anzeigen
In den letzten zwanzig Jahren hat die Chemie viele wichtige Instrumente und Verfahren für die Biologie hervorgebracht. Heute können wir Proteine herstellen, die in der Natur bisher nicht vorkommen. Es lassen sich Bilder von Ausschnitten lebender Zellen aufnehmen und sogar einzelne Zellen in lebendigen Tieren beobachten. Diese Woche haben zwei Forschungsgruppen der Universitäten Basel und Genf, die beide dem Nationalen Forschungsschwerpunkt Molecular Systems Engineering angehören, im Forschungsmagazin «ACS Central Science» präsentiert, wie man ein nicht-natürliches Protein designt, das völlig neue Fähigkeiten aufweist.
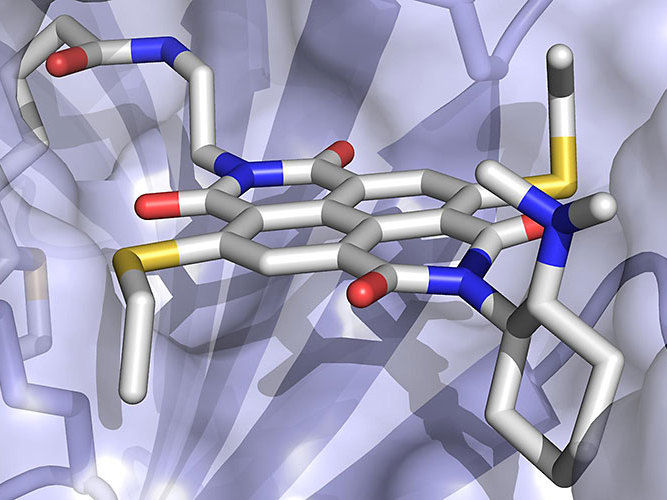
Das Anion-π-Enzym besteht aus einem elektronenarmen Aren-Kofaktor (graue Stäbchenrepresentation), eingebettet in ein Protein (als Oberfläche dargestellt).
University of Basel, Department Chemistry
Proteine sind die Arbeitspferde jeder Zelle. Sie bestehen aus Aminosäurebausteinen, die als Kette verbunden sind, welche sich zu funktionalen Maschinen zusammenfalten, um anschliessend alle wesentlichen zellulären Prozesse anzutreiben. Für diese Aufgaben benötigt die Natur zwanzig solcher Aminosäurebausteine zusammen mit ein paar spezialisierten Kofaktoren, die häufig zu der Gruppe der Vitamine zählen. Chemiker haben intelligente Wege gefunden, wie man das natürliche Proteinrepertoire beispielsweise durch das Hinzufügen zusätzlicher nicht-natürlicher Aminosäuren oder Kofaktoren erweitern kann.
Die Forscher um Stefan Matile und Thomas Ward haben jetzt einen neuartigen Kofaktor geschaffen, welcher eine der klassischen Wechselwirkungen in Proteinen umkehrt: die Kationen-π-Bindung, also die Stabilisierung einer positiven Ladung durch Anlagerung an eine elektronenreiche Molekülebene. Die Natur verwendet diese Kationen-π-Bindungen bei der Herstellung von so wichtigen Molekülen wie Steroiden, Hormonen, Vitaminen, Sehpigmenten oder Duftstoffen, um Signale in das Gehirn zu vermitteln, Antigene zu erkennen und Ähnlichem.
Nun haben die Forschungsgruppen von Matile und Ward ihren neuen Kofaktor und das daraus resultierende künstlichen Protein verwendet, um zusammen das erste «Anionen-π-Enzym» der Natur zu bauen. Darin ist die elektronenreiche durch eine elektronenarme Moleküleben ersetzt, wodurch eine negative Ladung während der Reaktion stabilisiert wird. Die Forscher konnten zeigen, dass Proteine mit dieser in der Natur nicht vorkommenden Funktionalität traditionelle organisch-chemische Katalysatoren in einer wichtigen, aber energetisch ungünstigen Reaktion bezüglich ihrer hohen Spezifität und Selektivität übertreffen. Die Forscher sind optimistisch, dass dieser Ansatz in Zukunft in Zellen verwendet werden kann, um bisher unmögliche chemische Transformationen zu ermöglichen.