Maßgeschneiderte Wirkstoffe überlisten Krankenhauskeime
Analyse enthüllt vielversprechenden Ansatz im Kampf gegen resistente Bakterien
Hamburger Forscher haben gemeinsam mit Kollegen aus Brasilien und China an DESYs Röntgenlichtquellen einen vielversprechenden Ansatz entwickelt, um antibiotikaresistente Krankenhauskeime zu überlisten. Statt diese sogenannten MRSA-Bakterien direkt zu attackieren, greifen die Wissenschaftler in einen für den Krankheitserreger lebenswichtigen Stoffwechselzyklus ein. Dadurch stellt das Bakterium eine nutzlose Variante des Vitamins B1 her. Ohne funktionierendes Vitamin B1 geht der Erreger zugrunde. Das Team um Prof. Christian Betzel von der Universität Hamburg und Prof. Carsten Wrenger von der Universität Sao Paulo stellt seine Arbeit im Fachblatt "Scientific Reports" vor.
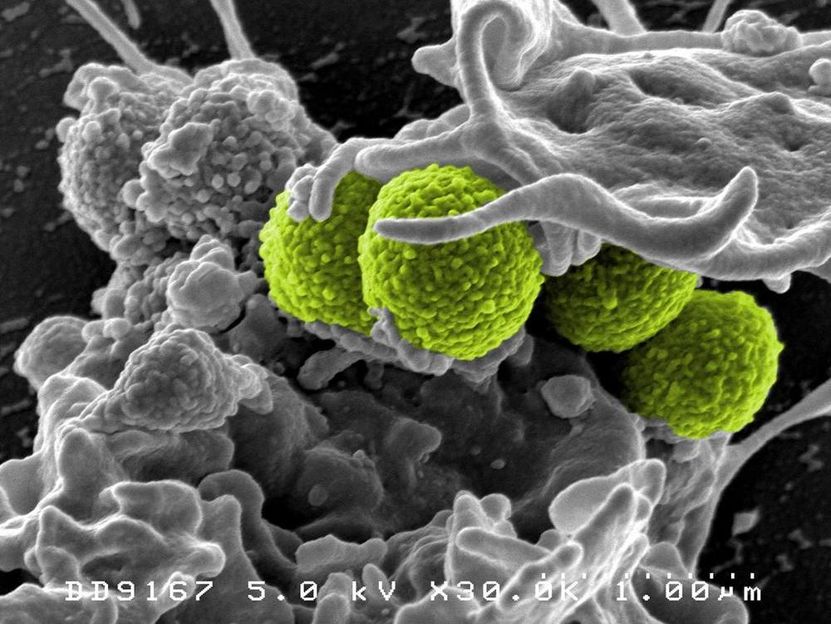
MRSA-Bakterien (grün) werden von einem weißen Blutkörperchen einverleibt.
National Institute of Allergy and Infectious Diseases (NIAID)
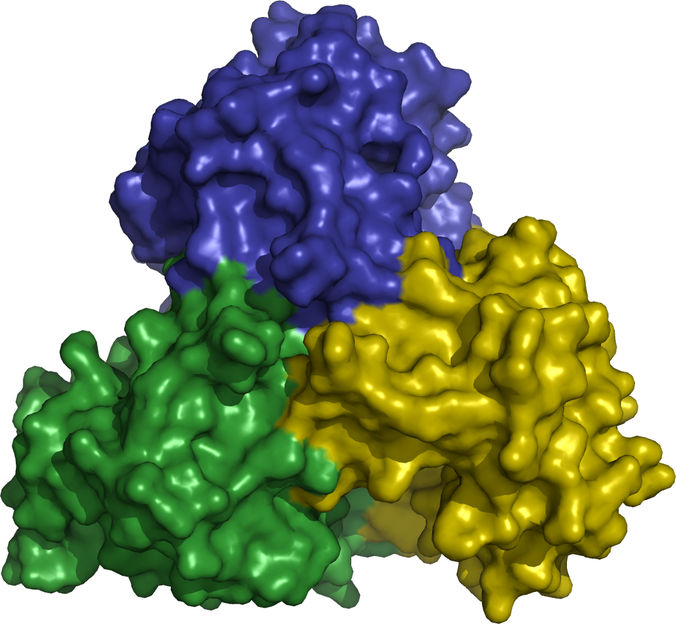
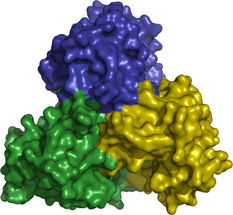
Das Enzym ThiM bildet ein Trimer.
Christian Betzel/Universität Hamburg
Antibiotikaresistenzen sind ein wachsendes Gesundheitsproblem. Immer mehr Bakterienstämme werden unempfindlich für bestimmte Antibiotika - sie lernen, sich auf die Attacken einzustellen, und entwickeln eine Immunität dagegen. Die wichtigste Waffe gegen bakterielle Infektionen droht damit stumpf zu werden. Sogenannte Methicillin-resistente Staphylokokken (MRSA) sind oft bereits gegen alle gängigen Antibiotika-Arten resistent und lassen sich nur noch mit Notfall- und Reservewirkstoffen bekämpfen. Während MRSA zunächst nur in Krankenhäusern auftraten, wo sich durch die Häufung von Keimen und Antibiotika leichter Resistenzen entwickeln können, werden inzwischen MRSA-Infektionen auch außerhalb von Gesundheitseinrichtungen beobachtet.
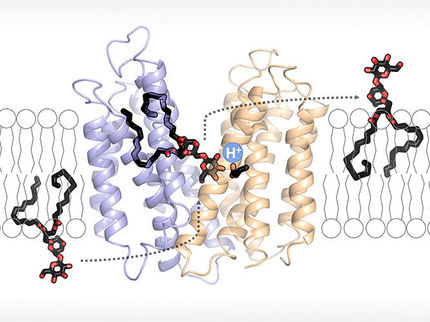
Auf der Suche nach neuen Mitteln gegen die widerstandsfähigen Keime hat das Team um Betzel und Wrenger einen neuen Weg eingeschlagen. „Klassische Wirkstoffe blockieren eine bestimmte Funktion des Bakteriums“, erläutert Betzel. „Dann kann das Bakterium einen Weg um die Blockade herum entwickeln und wird dadurch resistent gegen diesen Wirkstoff.“ Die Forscher greifen dagegen geschickt in den Vitamin-B1-Zyklus der Staphylokokken ein, ohne diesen zu blockieren. Das Bakterium muss das lebenswichtige Vitamin selbst herstellen. An den Messstationen des Europäischen Molekularbiologie-Labors EMBL bei DESY haben die Wissenschaftler die Struktur eines daran beteiligten Enzyms atomgenau bestimmt. Die Wissenschaftler „füttern“ dieses Enzym dann mit einer maßgeschneiderten, scheinbar nützlichen Zutat. Dieses sogenannte Substrat ist jedoch gegenüber der natürlichen Variante ganz leicht verändert, so dass eine nutzlose Form des Vitamins entsteht.
„Damit überlisten wir den Organismus“, erläutert Betzel. „Wir geben ihm etwas, von dem er glaubt, dass er es benötigt – aber in leicht veränderter Form, so dass er letztlich nichts damit anfangen kann. Im Idealfall bemerkt das Bakterium den Grund gar nicht, weil der Vitamin-B1-Zyklus ja weiter funktioniert.“ Das Vitamin eignet sich dabei nach Ansicht der Forscher aus zwei Gründen besonders als Ansatzpunkt. „Der Vitamin-B1-Zyklus ist sehr essenziell. Dazu gibt es kaum alternative Wege“, sagt Privatdozent Markus Perbandt von der Universität Hamburg, Ko-Autor der Studie. Und zudem: „Menschen haben kein ähnliches Enzym. Das ist sehr wichtig, um Kreuzreaktionen zu vermeiden.“
Doch wie muss das ideale Substrat genau aussehen, damit das Bakterium es auch annimmt? Dazu haben sich die Forscher mit Hilfe der DESY-Röntgenlichtquellen die atomare Struktur der beteiligten Enzyme angeschaut. „Am Vitamin-B1-Zyklus sind sechs Enzyme beteiligt. Vier davon sind bereits analysiert“, berichtet Betzel. „Am interessantesten davon ist das Enzym namens ThiM. Bei dem Substrat, mit dem wir dieses Enzym 'füttern', müssen wir nur zwei Atome verändern, um es nutzlos zu machen.“ ThiM ist ein sogenanntes Trimer. Das bedeutet, dass sich jeweils drei ThiM-Moleküle zu einem Komplex zusammenlagern. „Dieses Trimer hat damit drei aktive Zentren, die jeweils in den Grenzflächen der drei Moleküle liegen“, erläutert Betzel.
„Wenn man die Struktur der aktiven Zentren genau kennt, kann man gezielt ein nutzloses Substrat entwickeln“, sagt Perbandt. Doch das Enzym soll nicht nur das falsche Substrat benutzen, es soll es dem echten sogar vorziehen, das ihm ja ebenfalls zur Verfügung steht. Dafür machen die Forscher ihre Fälschung chemisch attraktiver, indem sie gezielt bestimmte Molekülgruppen anhängen. „Wir legen dem Bakterium quasi ein Stück Schokolade neben ein Stück trocken Brot“, sagt Betzel. „Das geht nur, wenn man die atomare Struktur des angesprochenen Enzyms genau kennt.“ Mediziner nennen derartige Wirkstoffe Prodrugs. Prodrugs entfalten erst durch die Verstoffwechselung in einem Organismus ihre Wirkung.
„Von ursprünglich zwölf Wirkstoff-Kandidaten haben sich drei als vielversprechend erwiesen“, berichtet Perbandt. „Mit denen finden nun Tests in Zellkulturen statt.“ Ob dabei schließlich ein neues Medikament entsteht, lässt sich noch nicht sagen. Doch der Ansatz, mit Hilfe der Kenntnis der atomgenauen Struktur eines Biomoleküls einen Wirkstoff maßzuschneidern, eignet sich nicht nur für Mittel gegen MRSA. „Diese neue Art der strukturbasierten Wirkstoffentwicklung ist zukünftig auch zur Bekämpfung anderer Erreger vielversprechend“, sagt Perbandt. Und die Methode hat weitere Vorteile: „Die strukturbasierte Wirkstoffentwicklung spart nicht nur Geld, sondern auch eine ganze Menge Tierversuche.“
Originalveröffentlichung
Julia Drebes, Madeleine Künz, Björn Windshügel, Alexey G. Kikhney, Ingrid B. Müller, Raphael J. Eberle, Dominik Oberthür, Huaixing Cang, Dmitri I. Svergun, Markus Perbandt, Christian Betzel & Carsten Wrenger; "Structure of ThiM from Vitamin B1 biosynthetic pathway of Staphylococcus aureus – Insights into a novel pro-drug approach addressing MRSA infections"; Scientific Reports; 2016