Gefahr weißer Hautkrebs: Was Hauttumorzellen unsterblich macht
Anzeigen
Der weiße Hautkrebs ist die häufigste Krebserkrankung des Menschen – und kommt immer öfter vor: Die steigende Lebenserwartung und langjährige Sonnenbestrahlung lassen die Hautkrebsfälle zunehmen. Dabei entsteht ein Tumor dieser Krebsart erst nach langer Zeit - betroffen sind vor allem Ältere, die in ihrer Jugend oft und lange in der Sonne waren. Forscher der Universitäten Mannheim und Aachen haben jetzt entdeckt, welchen Einfluss Stoffe in der Zelle bei der Entwicklung von Hautkrebs haben – und einige spielen eine gefährliche Doppelrolle.
Weißer Hautkrebs hat einen langen Atem: Die ersten Krebszellen entstehen teils Jahrzehnte vor der Entwicklung eines sichtbaren Tumors und werden erst durch weitere UV-Bestrahlung zu gefährlichen Karzinomen. Bestimmte Formen davon sind besonders heimtückisch, weil ihre entarteten Zellen gegenüber Strahlen- und Chemotherapie resistent werden – sie sind praktisch immun gegen Einflüsse von außen. Das macht vor allem das Plattenepithelkarzinom, eine Form von weißem Hautkrebs, sehr gefährlich.
Forscher suchen daher nach neuen Möglichkeiten, Hautkrebszellen zu zerstören. Dabei steht ein in den Zellen vorhandenes Eiweiß, das sogenannte cFLIP, im Zentrum: Es beeinflusst, ob sie als Krebszellen sterben oder unendlich weiterleben.
Protein mit doppeltem Gesicht
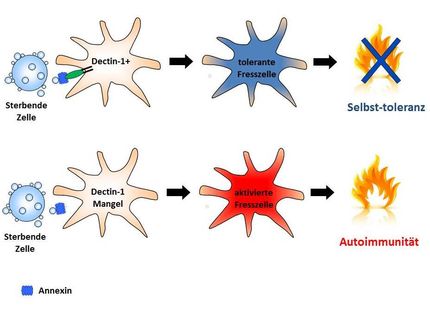
Denn normalweise sterben Zellen, wenn sie entartet oder geschädigt sind. Man nennt das den programmierten Zelltod, ein natürliches Sicherheitsprogramm. Die Zelle zerstört sich dabei auf verschiedene Weisen selbst, ausgelöst durch bestimmte Botenstoffe in den veränderten Zellen, aber auch aus anderen Zellen der Umgebung. Bei Krebs fällt der programmierte Zelltod jedoch aus: Die entarteten Zellen teilen sich unbegrenzt weiter.
Die Botenstoffe, die den Zelltod auslösen können, kommen oft von den Abwehrzellen des Immunsystems, die die kranke Zelle entdeckt haben. Die Immunzellen, wie etwa sogenannte natürliche Killerzellen, senden dann Botenstoffe aus, die an die Oberfläche der kranken Zellen andocken und den Zelltod herbeiführen. Ist aber viel cFLIP in vorhanden, kehrt sich die Wirkung dieser Kampfbotenstoffe plötzlich um: Sie lösen dann keine Selbstzerstörung der Zelle aus, sondern schalten stattdessen tumorfördernde Signalwege an – der Ausgangspunkt von Krebs.
Viren helfen bei der Krebsforschung
Forscher um Dr. Martin Leverkus haben nun aufgeklärt, welche Bedeutung das zwiespältige Molekül cFLIP für die Zelle hat, wo es in verschiedenen Formen vorkommt. Die Gruppe arbeitete dazu mit Viren, die sie als eine Art Fähre benutzten. Denn Viren können in Körperzellen eindringen und deren Gene verändern. Diese Fähigkeit nutzten die Wissenschaftler, um verschiedene Formen von cFLIP in Hautkrebszellen zu transportieren. Die Ergebnisse erhellen bisher unbekannte Zusammenhänge zwischen cFLIP, Zellbotenstoffen und dem programmierten Zelltod
„Nachdem wir das Eiweiß cFLIP in die Zellen eingeschleust hatten, passierte Erstaunliches: Einige Zellen zerplatzten geradezu, andere gingen unauffällig ein. Wir konnten also verschiedene Arten des programmierten Zelltodes beobachten“, sagt Martin Leverkus.
So ließ eine kurze Form von cFLIP die Zelle ungeordnet zerplatzen, von den Forschern „programmierte Nekrose“ genannt. Eine andere Form des Zelltods, das deutlich stiller ablaufende Sterben, die Apoptose, ist dabei blockiert. Weitere Varianten von cFLIP hemmen sowohl den stillen Zelltod als auch das Zerplatzen, die Nekrose. Sind beide Wege gehemmt, fällt der Zelltod aus und der Tumor kann wachsen.
Diese Erkenntnisse wollen sich die Forscher jetzt zunutze machen, um den Hautkrebs zu bekämpfen und Tumoren in der Haut zu zerstören: „Wenn wir genau wissen, wodurch cFLIP in der Zelle reguliert wird, könnte man daraus Verfahren entwickeln, mit denen in Hautkrebszellen gezielt der Zelltod ausgelöst werden kann.“
Neue Perspektive auch bei Entzündungen
Darüber hinaus könnten die neu entdeckten Mechanismen und Signalwege auch bei der Behandlung von Entzündungskrankheiten der Haut bedeutsam sein: Wenn Zellen durch Nekrose sterben, werden dabei zahlreiche intrazelluläre Signalstoffe im Gewebe frei, die wiederum Entzündungsvorgänge verstärken. Wenn es gelingt, mit speziellen Formen von cFLIP die Nekrose bei Entzündungen zu blockieren, oder bei Tumorzellen freizusetzen, könnten so zu starke (Entzündung) oder zu schwache (Tumoren) Reaktionen des umgebenden Gewebes verhindert werden.
Die ersten Ergebnisse der Arbeiten des Teams rund um Martin Leverkus, damals noch an der Universität Mannheim, wurden im internationalen Journal „Molecular Cell“ publiziert. Der Artikel zählt zu den fünf meist zitierten Beiträgen des Jahres 2011. Für seine Erkenntnisse zum programmierten Zelltod und die verschiedenen Signalwege hat Martin Leverkus im Mai 2015 den Oscar-Gans-Preis der Deutschen Gesellschaft für Dermatologie erhalten.
Die Wilhelm Sander-Stiftung hat die Arbeiten zu cFLIP mit 121.000 Euro unterstützt.
Originalveröffentlichung
Leverkus et al.; "cIAPs block Ripoptosome formation, a RIP1/caspase-8 containing intracellular cell death complex differentially regulated by cFLIP isoforms"; Molecular Cell 43, 449 – 463, 5. August 2011. Elsevier