Molekulare Leibwächter für unreife Membranproteine
Anzeigen
Ununterbrochen produzieren Maschinen in der Zelle lange Peptidketten, die Proteine. Damit ein Protein seine Aufgaben ordentlich erfüllen kann, muss es dann aber zunächst seine richtige räumliche Struktur einnehmen. In jeder Zelle gibt es dazu molekulare Helferproteine, genannt Chaperone. Sie passen auf die noch unreifen Proteine auf, helfen ihnen bei der Faltung und verhindern Fehler. Forscher um Sebastian Hiller, Professor am Biozentrum der Universität Basel und Daniel Müller, Professor am Department Biosysteme (D-BSSE) der ETH Zürich in Basel, haben herausgefunden, wie zwei Chaperone im Darmbakterium E. coli das Membranprotein FhuA beim Transport beschützen und ihm beim Einfädeln in die Membran assistieren.
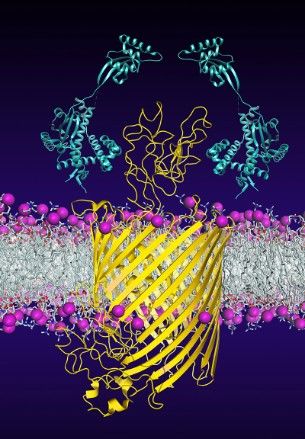
Chaperone (hellblau) helfen beim Einbau und der Faltung des bakteriellen Membranproteins FhuA (gelb).
Universität Basel, Biozentrum
Chaperone helfen beim Einfädeln von Membranprotein
Mithilfe des membranständigen Transporterproteins FhuA nehmen die Bakterien das für sie lebenswichtige Eisen, aber auch Antibiotika auf. Doch wie gelangt nun das sehr grosse, fassförmige FhuA-Protein unbeschädigt in die äussere Membran?
Um sich einen Weg in die äussere Membran zu ebnen, bedient sich FhuA der Hilfe zweier Chaperone. Mittels Strukturanalysen und Einzelmolekül-Kraftspektroskopie konnten die Forscher nun erstmals aufklären, wie die beiden Chaperone das noch unreife Protein stabilisieren und eine Fehlfaltung verhindern. «Dieser Vorgang ist überaus dynamisch», erklärt Hiller. «Im Schutz der Chaperone wechselt FhuA ständig innerhalb tausendstel von Sekunden seine Struktur. So kann es energetisch günstige Zustände suchen, die das schrittweise Einfädeln einzelner Proteinabschnitte in die Membran erst ermöglichen.» Mit dem Einbau des letzten Abschnittes erhält FhuA dann seine reife, funktionstüchtige Fass-Struktur. Ungeschützt würde sich FhuA falsch falten und schliesslich verklumpen.
Protein-Chaos ohne Chaperone
Chaperone sind massgeblich an der Bildung funktionstüchtiger Proteine beteiligt. Sie spielen für die richtige Faltung löslicher Proteine eine wichtige Rolle, und sind darüber hinaus für den Einbau von komplexen Proteinmolekülen in die äussere Membran von Bakterien notwendig. Da verschiedene Organellen in pflanzlichen und tierischen Zellen bakteriellen Ursprungs sind, schützen auch hier Chaperone auf ähnliche Weise die Proteine und helfen beim Einbau. Den Studien kommt daher höchste Wichtigkeit zu für Krankheiten durch fehlgefaltete Proteine, wie Alzheimer, Parkinson oder Mukoviszidose.
«Dass Chaperone andere Proteine vor Fehlfaltung schützen und deren korrekte Faltung begünstigen, ist schon länger bekannt. Durch unsere Arbeit konnten wir nun erstmals an biologischen Zellen aufzeigen, wie Chaperone die für die Pharmaforschung wichtigen Membranproteine bei der Faltung unterstützen», erklärt ETH-Professor Daniel Müller. Bisher habe man dies fast ausschliesslich anhand künstlicher Umgebungen untersuchen können. Dadurch habe man jedoch kaum verstanden, wie sich Proteine in die Membran einer Zelle falten.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!