FIC-Proteine versetzen Bakterien in den Winterschlaf
Bakterien verblüffen uns mit ihren Überlebensstrategien immer wieder aufs Neue. Wissenschaftler am Biozentrum der Universität Basel haben nun herausgefunden, wie Bakterien sich mithilfe eines sogenannten FIC-Toxins in einen Schlafzustand versetzen können. In der aktuellen Ausgabe von «Cell Reports» zeigen die Forscher den genauen Wirkmechanismus und erklären, wieso ihre Entdeckung neue Einblicke in die Evolution von Krankheitserregern gibt.
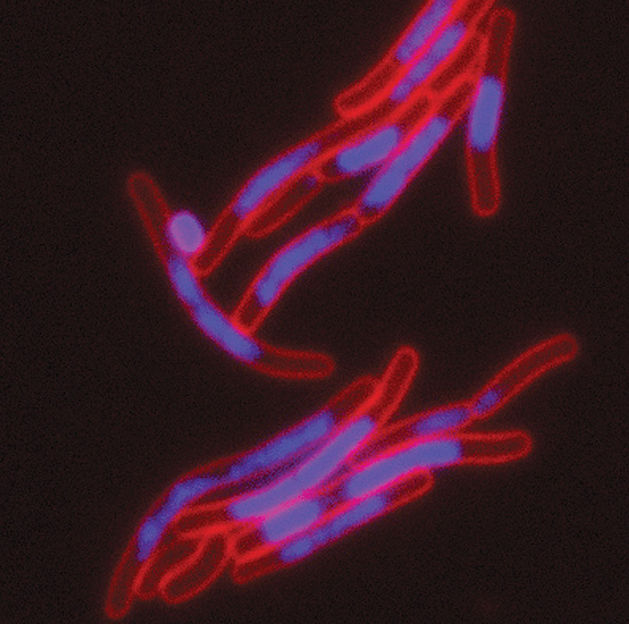
FIC-Toxine verändern die räumliche Struktur der DNA (blau) von Bakterien (rot: Zellmembran).
© Universität Basel, Biozentrum
Für viele Gifte gibt es Gegengifte, die die Wirkung des Giftes wieder aufheben. Ganz ähnlich funktionieren sogenannte Toxin-Antitoxin-Systeme in Bakterien: Solange die Zelle ein Antitoxin produziert und dadurch das Toxin neutralisiert, wächst sie normal. Sobald das Antitoxin aber abgebaut wird, ausgelöst beispielsweise durch widrige Lebensbedingungen, wird das Toxin wirksam und hemmt wichtige zelluläre Vorgänge.
Diese Systeme wirken daher wie ein Schalter, der in das bakterielle Wachstum eingreift und die Zellen in eine Art Schlafzustand versetzt, in dem sie zum Beispiel vor der Wirkung von Antibiotika geschützt sind. Die Forschungsgruppe von Prof. Christoph Dehio vom Biozentrum der Universität Basel hat nun einen neuen Wirkmechanismus von Toxinen aus der Gruppe der FIC-Proteine entdeckt.
FIC-Toxin versetzt Bakterien in Schlafmodus
In der Bakterienwelt sind Toxin-Antitoxin-Systeme weit verbreitet. Meist hemmen die Toxine die Proteinbildung oder die Energieversorgung des Bakteriums. Die Forscher um Dehio haben nun solche Toxine erstmals unter den über den gesamten Stammbaum des Lebens verbreiteten FIC-Proteinen entdeckt und konnten zeigen, dass diese über Veränderungen an der DNA wirken. Demnach modifizieren die FIC-Toxine zwei Zielproteine, sogenannte Topoisomerasen, die der DNA der bakteriellen Zelle ihre charakteristische verdrillte Form geben und deren räumliche Struktur überwachen. Durch die neuen Toxine wird deren Aktivität komplett herunter gefahren.
«Man kann sich das so vorstellen, als ob bei den Topoisomerasen der Stecker gezogen wird», erklärt Alexander Harms, Erstautor und Fellowships For Excellence-Stipendiat des Biozentrums. Dadurch kommt es rasch zu massiven Veränderungen der Raumstruktur der DNA, wodurch die Bakterien in eine Art Schlafzustand fallen.
Neue Einblicke in die Evolution von Krankheitserregern
FIC-Proteine besitzen ein breites Spektrum an molekularen Aktivitäten. Bis jetzt wurde zumeist an FIC-Proteinen geforscht, die von krankheitserregenden Bakterien als Virulenzfaktoren in Wirtszellen injiziert werden. Die Forscher um Dehio konnten in ihrer Studie nun erstmals eine Funktion von entwicklungsgeschichtlich ursprünglicheren FIC-Proteinen zeigen, die ihre Wirkung noch in Bakterienzellen selbst entfalten. Diese Entdeckung könnte dabei helfen, nachzuvollziehen, wie Krankheitserreger und ihre Werkzeuge in der Evolution entstehen.
Als Nächstes möchte Dehios Team die evolutionäre Verbindung von diesen ursprünglichen FIC-Toxinen zu den FIC-Proteinen aufklären, die von verschiedenen Erregern in Wirtszellen eingeschleust werden.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Alexander Harms, Frédéric Valentin Stanger, Patrick Daniel Scheu, Imke Greet de Jong, Arnaud Goepfert, Timo Glatter, Kenn Gerdes, Tilman Schirmer & Christoph Dehio Adenylylation of Gyrase and Topo IV by FicT Toxins Disrupts Bacterial DNA Topology Cell Reports (2015)
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.