Knick im Molekül macht Parkinson-Protein zum Aggregations-Hemmer
Strukturell verändertes α-Synuclein bildet keine toxischen Aggregate mehr und hemmt Verklumpung anderer Proteine
Aggregate des körpereigenen Proteins α-Synuclein gelten als Auslöser der Parkinson-Erkrankung im Gehirn. Wie Jülicher und Düsseldorfer Wissenschaftler jetzt beobachtet haben, verliert das Protein seine fatale Tendenz zur Aggregation, wenn die molekulare Struktur an einer kritischen Stelle verändert wird. Das modifizierte α -Synuclein hemmt zudem die Aggregation von Proteinen, die mit Alzheimer und Diabetes Typ II in Verbindung stehen. Der Effekt, den die Forscher in der aktuellen Ausgabe der Fachzeitschrift "Angewandte Chemie" beschreiben, könnte Ansätze für neue therapeutische Strategien liefern und dazu beitragen, die auffälligen Überlappungen zwischen unterschiedlichen neurodegenerativen Krankheiten zu erklären.
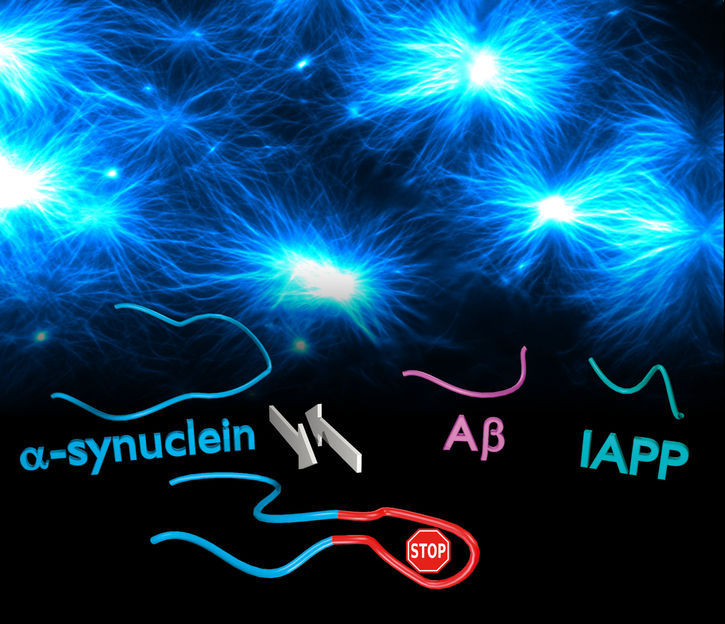
Eine zusätzliche chemische Bindung in der Molekülstruktur von α-Synuclein fixiert zwei bindungsfreudige Segmente aneinander (rot markiert). So wird unterbunden, dass sich die Protein-Teilchen zu faserartigen Aggregaten zusammenlagern, die als Ursache der Parkinson-Krankheit gelten (im Hintergrund zu sehen). Das modifizierte Protein verhindert zudem die Aggregation anderer krankheitsrelevanter Proteine, wie Aβ (Alzheimer) und IAPP (Diabetes II).
Copyright: Forschungszentrum Jülich / HHU Düsseldorf
Im Verlauf der Parkinson’schen Erkrankung verkleben Einzelmoleküle des Proteins α-Synuclein miteinander und bilden toxische Aggregate. Eine bestimmte Stelle des Moleküls steht besonders in Verdacht, dabei eine entscheidende Rolle zu spielen: Der Abschnitt enthält die bindungsfreudigen Segmente beta 1 und beta 2, die sich im Kern von α-Synuclein-Aggregaten finden. Auch innerhalb des Moleküls binden die beta-Segmente vorübergehend aneinander. Wie es sich auswirkt, wenn diese Bindung dauerhaft fixiert wird, haben jetzt Wissenschaftler am Institut für Physikalische Biologie der Heinrich-Heine-Universität Düsseldorf und am Institut für Strukturbiochemie des Forschungszentrums Jülich getestet. In den genetischen Bauplan des Protein-Moleküls integrierten sie dazu eine sogenannte Disulfid-Brücke aus zwei Schwefelatomen, mit der die Segmente gewissermaßen zusammengeklemmt werden.
Das von den Forschern α-synCC genannte modifizierte Protein lagert sich nicht mehr zusammen und hat zudem einen Effekt auf andere krankheitsrelevante Proteine, mit denen es in Kontakt kommt: So hemmte es im Versuch die Ablagerung von natürlich vorkommendem α-Synuclein sowie von zwei Proteinen, deren Aggregate als Ursache der Alzheimer'schen Demenz und Diabetes mellitus Typ 2 gelten. "Auch das unmodifizierte α-Synuclein hatte auf diese beiden Proteine eine aggregationshemmende Wirkung. Die Wirkung des veränderten α-Synucleins war aber wesentlich stärker", sagt Dr. Wolfgang Hoyer, der die Studie leitete.
Auf welche Weise das veränderte α-Synuclein die Aggregation der anderen Proteine eingreift, ist noch nicht klar. "Unsere Ergebnisse deuten darauf hin, dass α-synCC sich ans Ende der bis dahin gebildeten Protein-Fibrillen setzt und dann keine weiteren Proteinmoleküle mehr andocken lässt", erklärt Hoyer. "Die neuen Erkenntnisse sind wichtig für die Weiterentwicklung therapeutischer Strategien und tragen auch dazu bei, die Zusammenhänge zwischen unterschiedlichen neurodegenerativen Krankheiten zu erklären", ergänzt Prof. Dieter Willbold, Direktor der beiden beteiligten Institute in Jülich und Düsseldorf.

























































